Wie sicher sind Allografts in Zeiten von Corona?
Keine Zweit-OP, schnelle Einheilung, gesicherter Nachschub – die Vorteile von Allografts haben zahlreiche Anwender überzeugt. Braucht es in Zeiten von Corona zusätzliche Hygieneregeln für den Einsatz von Allografts? Werden die Spender beispielsweise auf Corona getestet?
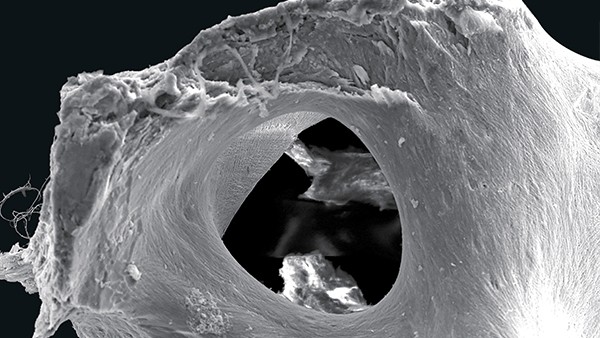
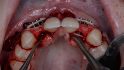
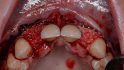
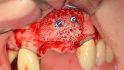
maxgraft bonebuilder besteht aus rein spongiösem Knochen von Lebendspendern nach Resektion der Fermurköpfe beim Einsatz einer Hüftendoprothese aus zertizifierten Entnahmezentren Europas (REM-Aufnahme, 100-fache Vergrößerung). © botiss (3 Bilder)
Ist die Patientenaufklärung über Biomaterialien wie Allografts in Zeiten von Corona aufwendiger?
Buchbinder: An der eigentlichen OP-Aufklärung hat sich meines Erachtens auch in Corona-Zeiten nichts verändert. Wesentlich elementarer ist derzeit jedoch die Patientenkommunikation in der Phase, bevor es überhaupt zu einer OP kommen kann.
Weil die Patienten aufgrund von Corona Termine verschieben?
Buchbinder: Korrekt, zahlreiche Patienten sind durch die Medien verunsichert, haben Angst sich anzustecken und verschieben vermeintlich unnötige Eingriffe, um den Weg zum Arzt oder Zahnarzt erst gar nicht antreten zu müssen. Das hat zum Teil verheerende Folgen für die Gesundheit.
Ärzte und Zahnärzte, die derzeit erfolgreich sind, haben verstanden, wie sie das Vertrauen der Patienten gewinnen können. Sie haben ihre Praxisabläufe und Hygienekonzepte so umgestellt, dass sich die Patienten schon vor dem Eingriff sicher fühlen. Eine tolle Initiative, um Praxen in dieser schweren Zeit zu unterstützen, wurde von unserem Vertriebspartner Straumann mit #togetherstrong ins Leben gerufen.
Kurz: Spezifisch für die Aufklärung über Biomaterialien hat sich durch Corona nichts verändert, so dass weiterhin unter anderem der Ursprung und mögliche Risiken tierischer und menschlicher Produkte wie Allografts besprochen werden sollten.
Bei xenogenen KEM ist die Hochtemperaturbehandlung üblich. Wäre das unter Hygieneaspekten in Zeiten von Corona auch für Allografts vorstellbar?
Buchbinder: Nein, der Vorteil von Allografts ist ja gerade, dass biologisch wertvolle Präparate von einem menschlichen Spender auf einen anderen menschlichen Empfänger übertragen werden, ohne dass deren Struktur und die Zusammensetzung grundlegend verändert werden müssen. Dadurch wird ein echtes Remodelling ermöglicht, denn die Allografts können resorbiert und durch vitalen Knochen ersetzt werden. Dies wurde eindrucksvoll durch histologische Untersuchungen nach dem Einsatz von maxgraft Spongiosagranulat gezeigt [1].
Eine thermische Behandlung menschlichen Gewebes würde die Präparate auf das eingeschränkte biologische Potenzial und die – manchmal natürlich gewünschte – drastisch verringerte Resorbierbarkeit von tierischen Knochenersatzmaterialien herabstufen, jedoch mit deutlich verringerter Verfügbarkeit und erheblich höheren Kosten. Von daher sehe ich hier keinerlei zielführende Notwendigkeit einer Anpassung der Aufbereitung von Allografts in Zeiten von Corona.
Wie lassen sich Infektionsübertragungen – etwa von Corona – denn dann bei Allografts sicher ausschließen?
Buchbinder: Um die Sicherheit von Biomaterialien wie Allografts zu gewährleisten, ist ein ganzes Bündel von Maßnahmen gesetzlich vorgegeben, die auch für Corona gelten. Dazu zählen
- die Spenderanamnesen,
- serologische Untersuchungen mittels Antikörperscreening und PCR (polymerase chain reaction),
- kontinuierliche mikrobiologische Testungen,
- die komplexe nass-chemische Desinfektion und Entfettung sowie
- die finale Gammabestrahlung der verpackten Einheiten.
- Alternative Aufbereitungsformen kommen vor, sind aber eher selten.
Immerhin: DNA-Reste sind in den allogenen Materialien noch enthalten. Gehen Sie von einer weiteren Verschärfung der Hygienemaßnahmen und Kontrollen von Allografts aus – nicht nur wegen Corona, sondern mit Blick auf die neue MDR?
Buchbinder: Bezüglich der allogenen Gewebezubereitungen, zum Beispiel maxgraft, ändert sich auch nach vollständigem Inkrafttreten der MDR nichts: Sie bleiben europaweit als menschliches Gewebe im Geltungsbereich der Direktive 2004/23/EC, in welcher insbesondere Spende, Entnahme und Testung geregelt sind. Für Deutschland bedeutet das, dass auch zukünftig eine Arzneimittelzulassung für Gewebeprodukte – Sehnen, Knorpel, Knochen, Haut – notwendig ist und das Medizinproduktegesetz hier nicht greift, da es sich bei diesen nicht um Derivate handelt. Ein umfassendes Statement dazu mit den entsprechenden Quellen kann gerne bei botiss angefordert werden.
Marinc: Alle implantierbaren Materialien tierischen Ursprungs und Materialien, die in maßgeblichem Umfang im Körper abgebaut werden – wie Knochenersatzmaterialien und Kollagenmembranen – wurden bereits in der Vergangenheit als Klasse-III-Medizinprodukte eingestuft. Für diese Produkte galten bereits unter der bisherigen Medizinprodukterichtlinie MDD sehr hohe regulatorische Anforderungen und Sicherheitsstandards. So muss für Produkte tierischen Ursprungs unter anderem ein Zoonosemonitoring durchgeführt und jährlich aktualisiert werden.
Was genau versteht man darunter?
Buchbinder: Dabei wird betrachtet, welche vom Tier auf den Menschen übertragbaren Krankheiten bekannt sind oder neu bekannt werden. Außerdem werden im Rahmen des Zoonosemonitorings die Maßnahmen, die das Risiko einer Übertragung verringern bzw. ausschließen sollen (z.B. Hygienevorschriften bei der Gewinnung des Rohmaterials oder spezielle Schritte in der Herstellung zur Inaktivierung von Pathogenen), evaluiert und bewertet. Eine Übertragung von potenziellen SARS-CoV-2-Viren kann durch die bereits etablierten Maßnahmen zur Virusinaktivierung ausgeschlossen werden.
Sowohl die Hochtemperaturbehandlung bei xenogenen Materialien als auch eine chemische Behandlung mit Ethanol und Wasserstoffperoxid, wie sie für die humanen Knochenersatzmaterialien und kollagenbasierten Produkte durchgeführt wird, inaktiviert effektiv Viren einschließlich des SARS-CoV-2-Virus [2].
Eine wichtige Änderung mit Einführung der MDR wird vor allem eine strengere klinische Überwachung der Produkte nach dem Inverkehrbringen sowie strengere Anforderungen zum Erbringen klinischer Nachweise für Medizinprodukte der Klasse III sein. Dies bedeutet zum einen, dass sich die Befugnisse der Benannten Stellen erhöhen und zukünftig vermehrt unangekündigte Audits sowie Stichproben- und Produktprüfungen möglich sind. Zum anderen gelten noch strengere Anforderungen an die Produktsicherheit und -leistungsfähigkeit. Dies führt dazu, dass Hersteller verstärkt in die Pflicht genommen werden, klinische Daten zu dokumentieren.
Was genau wird sich ändern?
Marinc: Für etablierte Produkte kaum etwas, Voraussetzung:
- Die Produkte sind bereits lange auf dem Markt,
- es liegen ausreichend klinische Daten in Form von Studien/Publikationen vor
- und es wurde ein gutes Post Market Surveillance System eingerichtet.
- botiss ist daher gut aufgestellt, um auch nach Einführung der MDR den erhöhten Anforderungen zu entsprechen.
Gibt es bei den Gewebebanken, die u.a. Allografts bereitstellen, besondere Maßnahmen bezüglich Corona?
Buchbinder: Potenzielle Risiken beim Umgang mit Materialien menschlichen Ursprungs wie Allografts werden ohnehin kontinuierlich beobachtet und die Prozesse, sofern nötig, bezüglich Corona angepasst. Von daher sind wir gut vorbereitet, und die Corona-Pandemie ist bezüglich des Sicherheitskonzepts für die Versorgung mit Produkten menschlichen Ursprungs wie Allografts alles andere als kritisch zu bewerten.
Welche Maßnahmen wurden ergriffen?
Buchbinder: Frühzeitig nach Entdeckung von SARS-CoV-2 wurde durch unsere Partnergewebebank Cells and Tissue Bank Austria (C+TBA) mit Sitz in Krems, Österreich, eine entsprechende Risikoanalyse durchgeführt. Diese ergab, dass bereits einzelne Schritte des etablierten chemischen Prozesses potenzielle SARS-CoV-2-Viren wirkungsvoll eliminieren [3]. Hervorzuheben ist dabei die tief ins Gewebe eindringende Behandlung mit drei Prozent Wasserstoffperoxid und Ethanol in verschiedenen Konzentrationen, die standardmäßig zur Desinfektion nach potenzieller Kontamination mit SARS-CoV-2 anerkannt ist [6], wobei sogar eine erheblich längerer Verweildauer des Gewebes in den Lösungen gewährleistet wird. Die Prozesse sind ja gerade darauf ausgelegt, ein breites Spektrum an verschiedenen potenziellen Erregern (Pilze, Sporen, Bakterien, RNA- sowie DNA-Viren) – behüllt und unbehüllt – mit unterschiedlichen Resistenzen wirkungsvoll zu inaktivieren. So lassen sich auch neu entdeckte oder noch unbekannte Erreger mit hoher Wahrscheinlichkeit entsprechend abdecken. Nicht zuletzt die trockene Lagerung über Wochen bis Monate, bis das fertige Gewebe eingesetzt wird, bietet abreichernde Wirkung, da das Virus auf verschiedensten Oberflächen lediglich eine Infektiosität von wenigen Tagen aufweist [4]. Man sollte dennoch nicht außer Acht lassen, dass der Hauptübertragungsweg eine Tröpfchen- bzw. Schmierinfektion ist, die höchste Viruslast in den Atemwegen zu finden ist und die Viruslast zum Beispiel im Serum bereits deutlich unter der im Sputum liegt [5].
Sprich: Die Viruslast bei Infizierten im Knochen ist gering?
Buchbinder: Gering, wenn überhaupt vorhanden. Deshalb sind Mutmaßungen über Infektionen beim Knochenaufbau eher hypothetische Ausführungen. Eine Übertragung durch Blut oder Gewebe ist bisher nicht beschrieben worden. Trotzdem bietet die Aufbereitung wie gesagt natürlich die nötige Sicherheit.
Wie gestaltet sich die Spender-Anamnese? Werden die Spender für Allografts beispielsweise auf Corona getestet?
Buchbinder: Für Gewebezubereitungen gibt es von Seiten des Paul-Ehrlich-Instituts eine Empfehlung zur detaillierten Anamnese von Spendern. Sie sieht den Ausschluss von Spendern vor, die 14 Tage vor Gewebeentnahme mit bestätigt SARS-CoV-2-Infizierten Kontakt hatten, bzw. innerhalb von 14 Tagen nach Genesung. Diese Empfehlung trifft aber explizit nicht auf Gewebezubereitungen zu, welche einem validierten Inaktivierungsverfahren für behüllte Viren unterzogen werden.
Auch aus dem Ausland gab es bereits eine behördliche Anweisung an uns, den Entnahmezeitpunkt mit anzugeben und bei Entnahme des Gewebes nach Auftreten von SARS-CoV-2 bestimmte Spender auszuschließen, zum Beispiel Personen bis zu 28 Tage nach Kontakt mit bestätigt Infizierten, nach Auslandsaufenthalt oder innerhalb von 28 Tagen nach Genesung von COVID-19.
Gilt die Anweisung nach wie vor?
Buchbinder: Nein, diese Auflage wurde nach entsprechender Aufklärung umgehend aufgehoben, da auch die Behörde kein Risiko einer Übertragung für die Patienten mehr sah.
Ist diese Lockerung bei Allografts angesichts der allgemein so strengen Corona-Maßnahmen nachzuvollziehen?
Buchbinder: Ja, alles andere wäre übertrieben, denn das Personal in der C+TBA arbeitet beim Umgang mit dem Spendergewebe grundsätzlich unter ausgesprochen hohen Hygienebedingungen im Reinraum. Zum Schutz des Personals sind keine über das normale Niveau hinausgehenden Corona-spezifischen Vorkehrungen zu Zeiten der Pandemie und darüber hinaus notwendig.
Zurück zum Herstellungsprozess: Immer wieder wird auf Proteine und Rest-DNA hingewiesen. Kann botiss genaue Angaben über die Bestandteile der allogenen Produkte und die Herstellung liefern?
Buchbinder: Gemäß der Arzneimittelzulassung und wie der Gebrauchs- und Fachinformation zu entnehmen ist, enthalten unsere Präparate Knochengewebe aus spongiösen, kortiko-spongiösen oder kortikalen Anteilen. Anders als bei den sogenannten Derivaten menschlicher oder tierischer Gewebe, bei denen einzelne Substanzen aus den Geweben isoliert werden, wird die Struktur und Zusammensetzung bei den Knochenpräparationen beibehalten, die zelluläre Substanz jedoch fast komplett entfernt.
Entgegen der zum Teil verbreiteten Meinung, alle organischen Bestandteile von Allografts müssten durch die Aufbereitung entfernt werden, sollen diese ja gerade beibehalten werden. Sie machen wie im nativen Knochen etwa 30 Prozent der Knochensubstanz aus, überwiegend Kollagen. Im Vergleich hat fast jede Kollagenmembran 100 Prozent tierische organische Bestandteile und wird trotzdem zu jedem Zeitpunkt und vollkommen zu Recht bedenkenlos verwendet. Würde man das Kollagen aus den allogenen Blöcken komplett entfernen, hätte man einen zwar reinen, aber sehr spröden Block, der sich kaum verschrauben lässt.
Gibt es auch andere Alternativen?
Marinc: Man kann nachträglich das rein mineralische Knochenersatzmaterial wieder mit Kollagen, zum Beispiel porciner Herkunft, mischen und sogenannte Kompositmaterialien erzeugen. Es gibt einige Materialien auf dem Markt, die diesen Ansatz verfolgen. Diese Materialien können zwar – im Vergleich zu rein mineralischen Produkten – durch das enthaltene Kollagen verbesserte biologische Eigenschaften aufweisen. Allerdings weisen sie in der Regel eine den allogenen Blöcken unterlegene mechanische und Resorptionsstabilität auf, wodurch sie sich für Blockaugmentationen eher nicht eignen.
Liegt die Zukunft möglicherweise eher in synthetischen Materialien?
Marinc: Synthetische Materialien, vor allem basierend auf Calciumphosphat, sind schon lange im Dentalbereich erhältlich. In den vergangenen Jahren war das Vertrauen in synthetische Produkte allerdings nicht so hoch wie in bovinen Knochen. Sie wurden zudem weniger akzeptiert. Dies liegt vielleicht auch an der Inhomogenität der Gruppe synthetischer Biomaterialien. Diese umfasst eine Vielzahl sehr unterschiedlicher Materialien mit entsprechend sehr unterschiedlichen Eigenschaften. Im Dentalbereich haben sich vor allem biphasische Materialien aus Hydroxylapatit und beta-Tricalciumphosphat durchgesetzt, etwa maxresorb von botiss. Aufgrund ihrer Zusammensetzung aus einer schnell und einer langsam resorbierenden Komponente bieten sie eine kontrollierte Resorption und haben gezeigt, dass sie in einer Vielzahl an Indikationen eine valide Alternative zu humanen oder bovinen Produkten darstellen. Momentan sehen wir einen verstärkten Trend zu synthetischen Materialien.
Rogge: Schon 2018 haben wir mit unserer blauen permamem-Membran ein Produkt geschaffen, das diesen Bedarf bedient. Die nicht resorbierbare dPTFE-Membran erfreut sich seither größter Beliebtheit bei Zahnärzten, da sie sehr dünn und dadurch extrem gut im Handling ist.
Marinc: Neben ihrem synthetischen Ursprung bietet die permamem auch andere Vorteile gegenüber Kollagenmembranen. Da sie nicht resorbiert wird und sie aufgrund ihrer hochdichten Struktur die Penetration von Bakterien verhindert, kann die permamem in bestimmten Indikationen, zum Beispiel der Socket- oder Ridgepreservation, auch für die offene Einheilung verwendet werden [6]. Zudem weist sie eine höhere Formstabilität auf als Kollagenmembranen und ist daher auch für Augmentationen außerhalb der Kammkontur geeignet.
Wie bewerten Sie als Zahnärztin die Zukunft von synthetischen Materialien, Frau Dr. Rogge?
Rogge: Der Anteil der synthetischen Materialien im regenerativen Bereich wird in den nächsten Jahren sicherlich wachsen. Der Trend ist nicht zu übersehen. Man denke nur an vielen veganen Produkte, die derzeit auf dem Markt sind. Das zieht sich durch sehr viele Branchen, von der Kosmetik über die Fashion bis hin zur Lebensmittelindustrie. Vor zehn Jahren etwa war ein veganes Restaurant noch eine exotische Sache. Heutzutage sind sie in den europäischen Metropolen nicht mehr wegzudenken. Das Thema „veganer Lifestyle“ ist in der Mitte der Gesellschaft angekommen. Es gibt aber global auch Märkte, die aus anderen Gründen synthetische Materialien bevorzugen. Als globales Unternehmen müssen und wollen wir uns dem stellen.
botiss hat als Full Service Provider im Bereich der Biomaterialien den Anspruch, Premiumprodukte für alle Bereiche der Regeneration anzubieten. Dabei steht der einzelne Patient mit seinen konkreten Bedürfnissen im Mittelpunkt. Jeder Patient und jeder Fall haben individuelle Ansprüche. Um optimale und vorhersagbare Ergebnisse zu erzielen, müssen die Produkte möglicherweise kombiniert werden – auch um den Anforderungen bestimmter Indikationen gerecht zu werden. Daher umfasst das 360°-Regenerationssystem von botiss ja auch verschiedene Produkte, mit deren Hilfe der Behandler in der Lage ist, das Optimum für seinen Patienten zu erreichen. botiss steht für Innovation. Gerade auch, um den synthetischen Markt weiter zu stärken und zu bedienen, wurde in der hauseigenen Entwicklungsabteilung hart daran gearbeitet, eine für die Zahnmedizin komplett neue Produktlinie aus einer synthetischen, resorbierbaren Materialklasse zu entwickeln. Geplant ist ein vollumfängliches GBR-System, bestehend aus einer Membran und einem Fixationssystem. Wir reden von biodegradablen Metallen – in unserem Fall resorbierbares Magnesium in seiner metallischen Form.
Warum gerade Magnesium?
Rogge: Bei der Entwicklung unserer neuesten Membran suchten wir nach einem starken, jedoch formbaren synthetischen Material, das vom Körper leicht absorbiert werden kann und später nicht mehr entfernt werden muss.
Unsere Lösung kommt aus dem orthopädischen und kardiovaskulären Bereich. Für orthopädische Anwendungen wurden bioresorbierbare Implantate auf Magnesiumbasis, deren mechanische Eigenschaften denen des Knochens ähnlicher sind, als Alternativen zu Implantaten aus Stahl, Titan und Co-Cr-Ni-Legierungen entwickelt [7, 8]. Während die geringe Korrosionsbeständigkeit von Magnesium – insbesondere in elektrolytischen wässrigen Umgebungen – bei technischen Anwendungen nachteilig ist, wird sie bei Biomaterialanwendungen zu einer gewünschten Eigenschaft. Weltweit ist botiss nach unserem Kenntnisstand damit die erste und einzige Firma in der zahnmedizinischen Industrie, die magnesiumbasierte Produkte in Kürze zur Marktreife bringt.
Aber das Problem bei Magnesium ist, dass bei dem Abbau Gas entsteht. Kann das im Gewebe um das Augmentat zu Komplikationen führen? Wie haben Sie das gelöst?
Rogge: Interessanterweise ist es so, dass die Idee, Magnesium als Biomaterial zu verwenden, schon mehr als 100 Jahre alt ist. Ein limitierender Faktor war in der Vergangenheit, dass die Wasserstoffgasentwicklung beim Abbau des Materials eher unkontrolliert vonstatten ging. Dennoch wird in chirurgischen Fallberichten dargestellt, dass obwohl die meisten Patienten subkutane Gashohlräume – verursacht durch zu schnelle Implantatkorrosion – zeigten, sie keine Schmerzen hatten. Bei der postoperativen Nachsorge wurden zudem fast keine Infektionen beobachtet.
Fast alle Patienten profitierten von der Behandlung. Heute ist man mit metallurgischen Technologien viel weiter und kann die Degradation des Produkts und die damit einhergehende Gasentwicklung kontrollieren. Sie ist auf die Indikation des Produkts abgestimmt. Wie genau, bleibt natürlich Firmengeheimnis. Allerdings ist es wie bei allen Innovationen der Fall, dass auch das Handling des neuen Materials vermittelt werden muss. Natürlich gibt es Abweichungen im Gebrauch zu beispielsweise der Verwendung einer Kollagenmembran. botiss ist die Weiterbildung schon immer ein sehr großes Anliegen gewesen. Daher ist es für uns selbstverständlich, dass wir für die NOVAMag-Linie Starterkurse anbieten werden, um dem Rechnung zu tragen. Darüber hinaus ist Magnesium ein im Körper reichlich vorhandener Mineralstoff, der in vielen Nahrungsmitteln natürlich vorkommt, anderen Nahrungsmitteln zugesetzt wird, als Nahrungsergänzungsmittel erhältlich und in Medikamenten wie Antazida und Abführmitteln enthalten ist. Es ist ein Kofaktor in mehr als 300 Enzymsystemen, die verschiedene biochemische Reaktionen im Körper regulieren, darunter Proteinsynthese, Muskel- und Nervenfunktion, Blutzuckerkontrolle und Blutdruckregulierung [9, 10]. Magnesium ist uns allen also sehr gut bekannt. Ich denke, dass darin auch ein Vorteil für die Patientenkommunikation liegt.
In unseren Augen ist NOVAMag das ideale Biomaterial, da es das Beste aus zwei Welten vereint: Einerseits hat es initial starke metallische Eigenschaften und andererseits bleibt dem Patienten das Entfernen der Materialien erspart. Für den Behandler bedeutet das zudem weniger Aufwand im Behandlungsablauf.
Kommen wir zur Weiterbildung: Was ist das Außergewöhnliche an der Online-Plattform botiss Campus?
Marinc: botiss Campus ist in seiner Form und Tiefe der Informationen besonders, da es kaum Portale gibt, die so viele Themenbereiche anbieten. Auf der Seite finden sich gebündelt alle Informationen zu den botiss-Biomaterialien. Sowohl klinische Fälle und Videos als auch Webinare, Publikationen und Informationen zu Fortbildungsveranstaltungen sind aufgeführt. Alle Inhalte sind nach Produkt und Indikation getagged. Dadurch können dem Besucher zu jedem einzelnen Beitrag immer weitere, themenbezogene Beiträge angeboten werden. Alle Inhalte können sowohl thematisch, produkt- oder indikationsbezogen oder nach Autoren/Referenten abgerufen werden. Inzwischen gibt es auf dem Campus bereits über 300 Autoren mit einem eigenen Profil.
Buchbinder: Unsere vollkommen frei zugängliche Campus-Seite spiegelt wider, was wir über die letzten Jahre als 360°-Welt der Regeneration immer weiter verfeinert haben: Ein abgestimmtes Portfolio von Biomaterialien, die sich in ihren Eigenschaften ergänzen und auf vielfältige Art und Weise miteinander kombiniert werden können, Vernetzung von Klinikern aus der ganzen Welt und das Bestreben, uns und unsere Produkte grenzenlos weiterzuentwickeln.
- Der klare Vorteil einer Hochtemperaturbehandlung liegt in der daraus resultierenden Sicherheit. Bei der Herstellung des xenogenen KEM cerabone wird das Rohmaterial zum Beispiel mittels eines ausgeklügelten Verfahrens schrittweise auf über 1200°C erhitzt. Neben der Temperatur kommt hier nur Wasser zum Spülen zum Einsatz, das KEM ist somit frei von chemischen Zusätzen.
- Durch die Erhitzung werden jegliche organischen Bestandteile wie Zellen und Proteine sowie Bakterien und Viren sicher entfernt und sogar Prionen inaktiviert, welche Auslöser der Kreuzfeld-Jakob-Krankheit sind [11]. Gleichzeitig wird durch diesen Herstellungsprozess eine hohe Kristallinität [12] erreicht. Beides trägt dazu bei, dass cerabone eine extrem hohe Volumenstabilität bietet und nach der Implantation dauerhaft im augmentierten Bereich verbleibt. Ein Remodelling findet, anders als bei allogenem Material, nicht statt, was bei bestimmten Indikationen ja auch gewünscht ist. Dazu gehören die Augmentation horizontaler Defekte im ästhetischen Bereich, die Anwendung als Resorptionsschutz bei autologer oder allogener Blockaugmentation sowie die Socketpreservation – vor allem wenn noch nicht feststeht, ob und wann ein Implantat gesetzt werden soll.
- Eine Hochtemperaturbehandlung hat nicht grundsätzlich einen negativen Einfluss auf die poröse Struktur und Oberfläche. Das hängt vom jeweiligen Produktionsprozess ab. cerabone weist eine sehr gute Osteokonduktivität und Hydrophilie auf. Wegen des hohen Interesses am Thema der Hochtemperaturbehandlung hat botiss die Homepage 1200trust.com eingerichtet. Sie beinhaltet alle Informationen rund um den einzigartigen Produktionsprozess von cerabone und dessen Einfluss auf die Sicherheit und Eigenschaften des Produktes sowie viele Beispiele (Klinische Fälle, Videos, Webinare) für dessen klinische Anwendung.
Die Experten

Foto: privat
Dr. rer. nat. Benno Buchbinder
Managing Director Markets bei botiss für die Abteilungen Produktmanagement, Sales und Marketing, Stellvertretender Stufenplanbeauftragter gemäß AMG § 63a
benno.buchbinder@botiss.com

Foto: privat
Dr. rer. nat Christiane Marinc
Global Head of Product Management bei botiss, Sicherheitsbeauftragte gemäß MPG § 30
christiane.marinc@botiss.com

Foto: privat
Dr. Svenja Rogge
Zahnärztin, Head of New Developments & Techniques bei botiss, federführend für die Entwicklung des NOVAMag Systems verantwortlich
svenja.rogge@botiss.com