Knochenregeneration trotz erheblicher Dehiszenz

© Kämmerer/Buttchereit (20 Bilder)
Das Prinzip der GBR besteht in der Platzierung einer Barriere zwischen dem Weichgewebe und dem alveolären Defekt. Dadurch wird zum einen verhindert, dass die schnell proliferierenden Bindegewebszellen den knöchernen Defekt besiedeln. Weiterhin wird den sich langsamer teilenden osteogenen Zellen Zeit gegeben, in den aufzubauenden Bereich zu migrieren (Barriere- und Schutzfunktion). Zum anderen wird der augmentierte Knochen beziehungsweise das Knochenersatzmaterial stabilisiert (Stabilisierungsfunktion). Kommerziell erhältliche Barrieremembranen für die GBR-Verfahren können grob in nicht resorbierbare und resorbierbare Membranen unterteilt werden. Nicht resorbierbare Membranen bestehen meist aus Titan und Polytetrafluorethylen (PTFE, expandiertes und dichtes PTFE) und erhalten ihre strukturelle Integrität und Volumenstabilität über die gesamte Heilungsperiode hinweg aufrecht. Trotz ihrer erfolgreichen klinischen Anwendung in unterschiedlichen Indikationen stellt der spannungsfreie Wundverschluss eine Herausforderung dar und die notwendige Entfernung nicht resorbierbarer Membranen nach der Heilung erfordert einen erneuten chirurgischen Eingriff [4, 5].
Resorbierbar vs. nicht resorbierbar
Um einen optimalen Behandlungserfolg zu gewährleisten, sollen Barrieremembranen für die kieferchirurgische Anwendung folgende Kriterien erfüllen: Integration in das umgebende Gewebe, Biokompatibilität, Zellokklusivität, Permeabilität für Nährstoffe und eine einfache Anwendung [6]. Diese Haupteigenschaften der Barrieremembranen sowie die klinische Indikation sind entscheidend für die Anwendung der jeweiligen GBR-Technik.
Bei einem einzeitigen Vorgehen mit simultaner Implantation bieten sich resorbierbare Membranen an, während bei einem zweizeitigen Vorgehen nicht resorbierbare Membranen im Zuge der Implantation unproblematisch entfernt werden können. Weitere wichtige Kriterien für die Auswahl der am besten geeigneten Membran sind die benötigte Standzeit und die erforderliche Stabilität der Membran. Bei der GBR empfehlen sich Barrieremembranen mit einer Standzeit von mindestens drei bis sechs Monaten. Der Aspekt der Membranstabilität spielt dabei eine wichtige Rolle und ist u. a. von der Defektgeometrie abhängig.
Bei rein vertikalen oder horizontalen Defekten kann beispielsweise die Verwendung einer nicht resorbierbaren Membran anstelle einer resorbierbaren Membran sinnvoll sein, um so das augmentierte Volumen durch die plastische Deckung nicht zu reduzieren. Besonders für die Regeneration von Defekten außerhalb der Kieferkammkontur wird die Verwendung einer nicht resorbierbaren, volumenstabilen Membran empfohlen. Diese bietet im Vergleich zu resorbierbaren Membranen eine höhere Stabilität und hat bessere raumschaffende Eigenschaften [7]. In der regenerativ-chirurgischen Zahnmedizin sind Membranen aus Polytetrafluorethylen (PTFE) die meistgenutzten nicht resorbierbaren Membranen [8]. Eine vergleichende klinische Studie untersuchte eine resorbierbare Membran und eine titanverstärkte ePTFE-Membran (ePTFE = (expandiertes) Polytetrafluorethylen) bei der GBR in Kombination mit einem bovinen, partikulären Knochenersatzmaterial. Die Ergebnisse zeigten, dass die ePTFE-Membran der resorbierbaren Membran bezüglich des erreichten Augmentationsvolumens deutlich überlegen war [9]. Faktoren, die den Erfolg einer GBR-Maßnahme mittels nicht resorbierbarer Membranen sekundär positiv beeinflussen können, sind – aus Sicht der Autoren – unter anderem sehr gute Mundhygieneverhältnisse, das Fehlen von Habits wie Nikotin- und Alkoholkonsum, eine präoperative und postoperative antibiotische Medikation sowie die Anwendung von Lokalantiseptika. Faktoren, die das klinische Bild positiv beeinflussen können, sind möglichst keine Belastung im Operationsgebiet während der gesamten Einheilphase (z. B. keine Prothesensättel) und regelmäßige Kontrollen, um Entzündungsprozesse oder Membranexpositionen rechtzeitig zu erkennen.
Der konkrete Fall
Ausgedehnte Knochendefekte erfordern eine längere Heilungszeit, da die vollständige Regeneration des Defekts von der Zahl der gebildeten Blutgefäße und der Rekrutierung von knochenbildenden Zellen abhängt, die von den Rändern des Defekes ausgeht und ins Zentrum des Defektgebiets fortschreitet [10]. Daher bestimmt die Dimension des Defekts die Zeit, in der eine Membran ihre Barrierefunktion aufrechterhalten sollte [11].
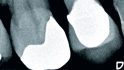
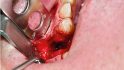
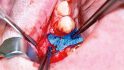
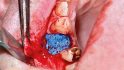
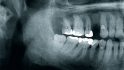
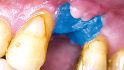
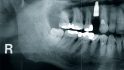
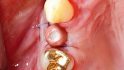
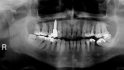
Der folgende klinische Fall dokumentiert die Behandlung eines 61 Jahre alten Patienten, der sich initial mit erheblichen Beschwerden an Zahn 14 vorgestellt hatte. Die radiologische Untersuchung (Abb. 1) ergab eine periapikale Aufhellung sowie eine insuffiziente Wurzelkanalbehandlung. Im Folgenden wurde die Krone entfernt und eine Revision der Wurzelkanalbehandlung durchgeführt. Im Rahmen der Revisionsbehandlung stellte sich eine Längsfraktur im Bereich der vestibulären Wurzel dar. Aufgrund der daraus resultierenden schlechten Prognose einer weitführenden konservierenden Therapie wurde der Zahn atraumatisch entfernt und die Alveole sorgfältig von Granula‧tionsgewebe und einem sich apikal befindenden Zystenbalg befreit (Abb. 2). Das gewonnene Gewebe wurde der histopathologischen Untersuchung zugeführt; dabei ergab sich das Bild einer radikulären Zyste. Aufgrund der latent vorhandenen Inflammation im Bereich der Alveole wurde auf eine sofortige Augmentation mit Knochenersatzmaterial im Sinne einer Ridge Preservation verzichtet. Die Alveole wurde konventionell mit einem Kollagenkegel und einer adaptierenden Naht versorgt. Nach Besprechung mit dem Patienten wurde eine implantatprothetische Versorgung geplant. In der ersten chirurgischen Phase (sechs Wochen nach der Extraktion) erfolgte ein horizontaler Alveolarkammaufbau mittels GBR-Technik unter Lokalanästhesie, um das abgebaute Knochengewebe wiederherzustellen und damit ein entsprechendes Implantatbett zu gestalten. Präoperativ zeigten sich vestibulär in regio 14 sowohl der Knochen als auch das Weichgewebe defizitär (Abb. 3). Im Rahmen der geplanten Augmentation erfolgte die Bildung eines lokalen Mukoperiostlappens in regio 14. Aufgrund der aus den vorhergegangenen operativen Eingriffen resultierenden Narbenzüge im OP-Gebiet wurde auf eine gängige Lappenextension über das Augmentationsgebiet hinaus verzichtet. Nach Lappenbildung konnte der wandige Defekt exploriert und intensiv mit physiologischer Kochsalzlösung gespült werden (Abb. 4). Im Anschluss erfolgten die Vorlage einer neuen nicht resorbierbaren Membran (permamem, botiss biomaterials, Zossen, Deutschland) sowie der Zuschnitt der Membran entsprechend der Größe des abzudeckenden Defekts (Abb. 5). Es folgte die Augmentation des wandigen Knochendefekts mit allogenem Knochenersatzmate‧rial (maxgraft spongiöse Granula, botiss biomaterials), das zuvor mit venösem Eigenblut des Patienten durchmischt worden war (Abb. 6 und 7). Danach wurde das Augmentat mit der vorgelegten nicht resorbierbaren Membran abgedeckt (Abb. 8). Der Wundverschluss erfolgte mittels horizontaler Matratzennaht und Einzelknopfnähten (Resolon 4.0/5.0, Resorba, Nürnberg, Deutschland) (Abb. 9). Die postoperativ angefertigte Halbseiten-Panoramaschichtaufnahme zeigte eine vollständige Augmentation der Defektregion (Abb. 10).
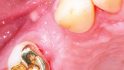
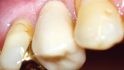
Bei der Nachbehandlung kam es ca. vier Wochen postoperativ zu einer Wunddehiszenz und einer damit verbundenen Membranexposition (Abb. 11). Mögliche Gründe dafür könnten, neben der minimalinvasiven Lappenausdehnung, u. U. auch die nicht vollständig ausgeheilte Weichgewebsdecke post extractionem bzw. die Verwendung einer nicht resorbierbaren Membran per se sein, da nicht resorbierbare Membranen aufgrund ihrer Steifigkeit anfällig für Lappenperforationen sind. Somit erhöhen sie das Risiko einer Weichgewebsdehiszenz und Membranexposition [12–16]. Normalerweise zeigt bei Expositionen und entzündlichen Erscheinungen im Gebiet der nicht resorbierbaren Membran der alleinige Therapieversuch mit systemischen und lokalen Antiseptika und Antibiotika keinen Erfolg. Daher ist in der Regel in solchen Fällen die sofortige Entfernung der Membran die einzige Therapiemöglichkeit.
Die Einheilung der Membran im o. g. Fall stellte sich jedoch in der folgenden Zeit reizlos dar, und die zur Mundhöhle exponierte Oberfläche zeigte kaum Akkumulation von Plaque. Da sich die klinische Situation somit als völlig reizlos darstellte, verblieb die eingesetzte Membran in situ. Vier Wochen nach der primären Exposition (ca. zwei Monate nach der Augmentation) löste sich die Membran sukzessive von der Unterfläche und wurde vom Patienten selbst entfernt. Darunterliegend befand sich ein dünner Saum von jungem Epithel ohne jegliche Zeichen von Inflammation. Der Patient erhielt wöchentliche Kontrolltermine sowie intensive Mundhygiene‧instruktionen. Es erfolgte keine Interimsversorgung im Bereich der Schaltlücke 14, um eine Belastung durch mechanische Reize zu vermeiden.
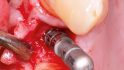
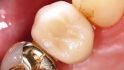
Die klinische und radiologische Verlaufskontrolle sechs Monate nach der GBR zeigte eine suffiziente Weichgewebssituation sowie ein solides knöchernes Implan‧tatlager in regio 14 bei mehr als 8 mm periimplantär fixierter Gingiva (Abb. 12 und 13). Für die eigentliche Implantation wurde ein Mukoperiostlappen geringer Ausdehnung gebildet und der augmentierte Bereich anteilig wiedereröffnet. Eine gute knöcherne Regeneration der ehemaligen Zahnalveole wurde dabei sichtbar (Abb. 14). Die allogenen Knochenpartikel waren fest in das neugebildete Knochengewebe integriert, Anzeichen von Bindegewebseinkapselung waren nicht sichtbar. Ein Titanimplantat (Straumann Bone Level Tapered, Institute Straumann AG, Basel, Schweiz) wurde mittels Bohrschablone gemäß der 3D-Planung an Position 14 – 2 mm subkrestal – inseriert und einer geschlossenen Einheilung überlassen (Wundverschluss Resolon 6.0, Resorba, Nürnberg, Deutschland). Die Implantatposition wurde postoperativ mittels Panoramaschichtaufnahme überprüft (Abb. 15). Vier Monate nach der Insertion wurde das Implantat freigelegt und ein individualisierter PEEK-Gingivaformer eingesetzt (Abb. 16). Bereits drei Wochen später folgte die prothetische Versorgung mithilfe einer verschraubten Metallkeramikeinzelkrone auf einem Titanimplantataufbau (Abb. 17 und 18). Eine Individualisierung der Farbgebung im Bereich des Kronenhalses wurde seitens des Patienten bei der Anprobe abgelehnt. Die Position der Krone wurde radiologisch dokumentiert und dient, zusammen mit den entsprechenden Sondierungstiefen, zur Verlaufskontrolle der Umbauvorgänge im Bereich des periimplantären Gewebes (Abb. 19).
Fazit
Die gesteuerte Knochenregeneration (GBR) mittels nicht resorbierbaren Membranen ist eine Behandlungsalternative, die in vielen Behandlungsfällen zu einem vorhersehbaren Ergebnis führt, eine ästhetisch ansprechende prothetische Versorgung ermög‧lichen kann und in vielen Fällen als Alternative zu aufwendigeren Augmentationsverfahren in Erwägung gezogen werden muss. Die Anwendung des Verfahrens sollte allerdings sehr gut geplant und auf mögliche Risikofaktoren Rücksicht genommen werden, da jeder Entzündungsprozess im Operationsgebiet zu einer vorzeitigen Entfernung der Membran und bis zum totalen Misserfolg der Maßnahmen führen kann. Ein engmaschiger Recall sowie die Mitarbeit und die Rücksichtnahme seitens des Patienten sind unentbehrlich. Das hier beschriebene GBR-Verfahren mittels PTFE-Membran zeigt trotz erheblicher Dehiszenz eine erfolgreiche Knochenregeneration.
Die Experten:
Dr. Ingo Buttchereit, stellv. Leiter der zahnärztlich-chirurgischen Poliklinik, Universitätsmedizin Rostock, Tätigkeitsschwerpunkt Implantologie, Direktor ITI-Studyclub.
PD Dr. Dr. Peer W. Kämmerer, Leitender Oberarzt/Stellvertretender Direktor der Klinik und Poliklinik für Mund-, Kiefer- und Gesichtschirurgie – plastische Operationen an der Universität Mainz.