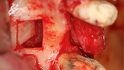
Minimalinvasive Blöcke
Keine Zweit-OP, perfekte Passung, einfaches Prozedere – die Vorteile patientenindividueller allogener Knochenblöcke überzeugen immer mehr Implantologen und Patienten. Der autologe Knochen verliert nun auch in Deutschland an Image. Gibt es einen neuen Goldstandard?
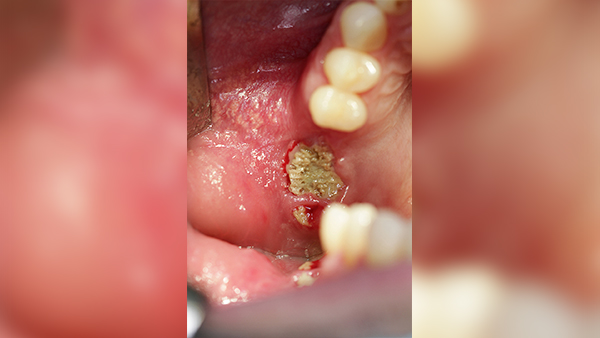
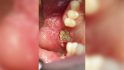
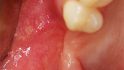
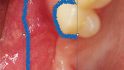
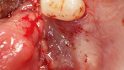
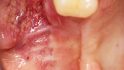
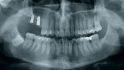
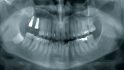
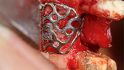
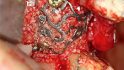
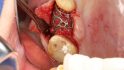
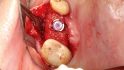
Fallbeispiel 1: Ausgangssituation Oberkieferseitenzahnbereich rechts, Augmentation alio loco mit autologem Knochen, Dehiszenz und Totalverlust des Blocks © Back/Blume
Patientenindividuelle allogene Knochenblöcke gewinnen klar an Akzeptanz. Wann sind sie indiziert?
Smeets: Das hängt von unterschiedlichen Faktoren ab. Eine entscheidende Rolle spielen die Weichgewebsdicke, die Weichgewebsmobilisierung, die postoperative Versorgung und klinische Risikofaktoren wie etwa das Rauchen. Dazu kommen die Passgenauigkeit, die Defektlokalisation sowie biologische und klinische Limitationen.
Was bedeutet das in der Praxis?
Buchbinder: Beginnen wir mit der Passgenauigkeit: Jede individuelle Planung ist nur so gut wie die Daten, auf denen diese beruht. Die Voraussetzung dafür sind eine klare Abgrenzung von Hart- und Weichgewebe und eine einheitliche Defektoberfläche. Schwierigkeiten bei der Passung sind daher bei relativ frischen Defekten mit Gewebe in der Heilung (schwacher Mineralisierungsgrad) und zerklüfteten Defektoberflächen zu erwarten. Auch braucht der Knochenblock ein vitales und stabiles Empfängerbett, sodass insbesondere in der Maxilla größere Perforationen hin zur Kieferhöhle zu Schwierigkeiten führen.
Nun zu den klinischen und biologischen Limitationen: Bei den zu erwartenden Dimensionsveränderungen des Kieferkamms spielt die Erfahrung des behandelnden Chirurgen eine große Rolle. Während in der Horizontalen eine Verbreiterung von 5–6 mm in der Regel mehr als ausreichend ist, um ein suffizientes Implantatlager zu gewinnen, braucht es bei vertikalen Defekten viel Fingerspitzengefühl: Die meisten Anwender können bis zu 3 mm vertikal relativ vorhersagbar beherrschen. Darüber hinaus spielen, wie Prof. Smeets schon erwähnte, Weichgewebsdicke und dessen Mobilisierung, postoperative Versorgung und Risikofaktoren wie beispielsweise das Rauchen eine entscheidende Rolle.
Verstehe ich das richtig: Ein vitales Empfängerbett ist ein Muss?
Buchbinder: Ein vitales Empfängerbett erleichtert vieles, es ist aber nicht immer zu realisieren. Je nach Hersteller stellen minder durchblutete Empfängerstellen gemäß Gebrauchs- und Fachinformation entweder eine Kontraindikation dar, oder es wird auf die Notwendigkeit einer sorgfältigen Abwägung des Einsatzes durch den Chirurgen hingewiesen.
Smeets: Mein Konzept ist es, den Knochen zum Anfrischen monokortikal anzubohren. Das ist zwar in der Literatur nicht klar belegt, in der Praxis aber äußerst erfolgreich.
Gilt das für autologen und allogenen Knochen?
Smeets: Dazu gibt es derzeit keine anwendbaren Studien.
Buchbinder: Bei beiden Varianten gibt es Befürworter der Perforierung der Empfängerstelle und Gegner. Insbesondere in der posterioren Mandibel bei sehr dickem kortikalem Knochen sehe ich aber keinen Nachteil, während im Oberkiefer überwiegend darauf verzichtet werden könnte.
Herr Dr. Blume, Herr Dr. Back, Sie setzen seit fünf Jahren in ihrer Praxis auf Augmentationen mit allogenen präfabrizierten Knochenblöcken. Warum?
Blume: Das Gros unserer Patienten lehnt Eigenknochen inzwischen ab und wünscht nach der Aufklärung aller Alternativen präfabrizierte allogene Blöcken. Dass sie perfekt in den Knochendefekt passen – wie ein Schlüssel in ein Schlüsselloch –, überzeugt. Es gibt keinen Totraum mehr, keinen Spalt zwischen transplantiertem und ortsständigem Knochen. Die Operationszeit ist kurz, das OP-Trauma gering und die Volumenstabilität ausgesprochen hoch. Eigenknochen lässt sich dagegen nicht passgenau fräsen, entsprechende OP-Verfahren gibt es einfach nicht.
Wie gehen Sie da konkret vor?
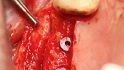
Back: Wir arbeiten mit unserem eigenen DVT-Gerät. Wir erstellen die Aufnahme des Knochendefekts, besprechen die Situation mit dem Patienten und klären über alle Behandlungsalternativen auf – vom allogenen Knochenblock bis hin zu osteoplastischen Verfahren wie Bonesplitting. Sollte sich der Patient für die Augmentation CAD/CAM-gefertigter allogener Blöcke entscheiden, senden wir die von uns generierten DICOM-Daten an das Unternehmen, das diese Technologie liefert, in unserem Fall ist das Botiss oder Zimmer Dental. Dort wird der dreidimensionale Knochenblock designt.
Wie lange dauert das?
Blume: Zirka sieben Tage. Wir kontrollieren nach Erhalt der Daten zusammen mit dem Patienten die Passgenauigkeit und bestellen dann den allogenen, individuell gefertigten Block, der nach vier bis sechs Wochen unsere Praxis erreicht. Erst ab diesem Zeitpunkt wird es für den Patienten kostenpflichtig.
Was sind die Hauptindikationen?
Blume: Wir konzentrieren uns auf kompliziertere Indikationen: Frontzahn, schwieriger Seitenzahnbereich im Oberkiefer, schwieriger Seitenzahnbereich im Unterkiefer.
Was ist die größte Herausforderung?
Back: Nach wie vor die Schnittführung. Im ersten Jahr hatten wir einige Dehiszenzen, wahrscheinlich aufgrund des immensen Volumenzuwachses durch die Transplantation. Wir haben deshalb von der eigentlich typischen Schnittführung, die auf dem Alveolarkamm entlangläuft, zu einer Schnittführung mit zwei vertikalen Inzisionen ins Vestibulum gewechselt, die dann verbunden wird über eine weit im Vestibulum liegende horizontale Inzision.
Blume: Die Schnittführung erinnert an den Sockel einer Säule, und wir haben sie deshalb Pillar Incision genannt. Der ganze Lappen im Oberkiefer wird dann nach palatinal präpariert. Im Unterkiefer läuft die Schnittführung etwas anders, aber ebenfalls ganz streng paramarginal. Wichtig: Die ortsständigen Zähne dürfen nicht berührt werden, denn dann drohen Dehiszenzen. Seitdem wir diese beiden Schnittführungen entwickelt haben, ist das Dehiszenzenproblem in unserer Praxis nahezu vom Tisch.
Worauf gilt es beim Einsatz allogener Materialien besonders zu achten? Was läuft anders als bei autologem Knochen?
Buchbinder: Bei Augmentationen über die eingangs erwähnten Grenzen hinweg sollte stets eine Risikoabwägung durchgeführt und evtl. doch dem autologen Knochen der Vorzug gegeben werden. Ein Schlüsselfaktor ist der Einsatz von Barrieremembranen. Azelluläre Allografts und andere Knochenersatzmaterialien müssen während der initialen Heilungsphase von schnell proliferierenden Fibroblasten abgeschirmt werden, um ein bindegewebiges Einscheiden der Materialien zu verhindern. (Wissenschaft‧liche Stellungnahme DGZMK).
Und das ist bei Eigenknochen nicht so?
Buchbinder: Nein, bei autologen Transplantaten wird ein Teil der Zellen lebend transplantiert und muss schnellstmöglich durch neu gebildete Blutgefäße – Neoangiogenese – mit Nährstoffen versorgt werden. Eine Barrieremembran wäre also eher hinderlich.
Welche weiteren Unterscheidungsmerkmale gibt es?
Blume: Der allogene Knochenblock weist aufgrund der unterschiedlichen Vorbehandlungen – er wird entwässert, entfettet, dezellularisiert – kaum noch echte Knochenbestandteile auf, lediglich Kalzium, Phosphor und Kollagen. Der Vorteil: Fettzellen sind nicht vorhanden und können sich somit auch nicht infizieren.
Damit fehlt es dem allogenen Knochenblock aber auch an biologischer Wertigkeit.
Blume: Im Vergleich zum autologen Knochen schon. Aber die biologische Wertigkeit allogener Materialien ist immer noch deutlich höher als die xenogener oder synthetischer Materialien.
Das heißt?
Buchbinder: Allografts können durch die normalen Remodellingprozesse langfristig durch körpereigenen lebendigen Knochen ersetzt werden, während mit bovinen und xenogenen Materialien keramo-ossäre Regenerationskomplexe entstehen, die auch ohne mechanische Belastung langfristig stabil bleiben. Ist also vorhersehbar, dass der augmentierte Bereich nicht mechanisch belastet werden wird, sollte bovinen Materialien der Vorzug gegeben werden, da diese keinen resorptiven Prozessen unterliegen und damit eine sehr gute Langzeitstabilität gewährleisten (Riachi et al. 2012/Lorean et al. 2014)
Blume: Viele Knochenersatzmaterialien, nicht nur die bovinen, sondern alle bis hin zu Algen, werden nicht nur entwässert, entfettet, dezellularisiert, wie Allografts, sondern zusätzlich thermisch behandelt, also im Hochofen bei bis zu 1350 °C gebrannt. Und dann erst entsteht etwa aus dem ursprünglichen Rinderknochen ein Kalziumphosphatgerüst.
Ein Hydroxylapatid also …
Blume: … genau, und das wird kaum resorbiert.
Es bleibt also im Prinzip als Fremdkörper bestehen?
Blume: So könnte man es formulieren. Der allogene Knochenblock wird dagegen komplett zu eigenem Knochen umgebaut. Es findet ein Um- und kein Einbau statt, dennoch hält der allogene Knochenblock ein sehr stabiles Volumen in der Einheilphase.
Den Volumenerhalt leisten fast alle Knochenersatzmaterialien doch auch.
Blume: Aber allogene Knochenblöcke sind kein Granulat. Und das ist ein entscheidender Vorteil, speziell in den Regionen, in denen wir unbedingt die vertikale Höhe erhalten wollen, etwa in der Oberkieferfront. Partikuläre Materialien können zusätzlich zu den Resorptionen auch noch kollabieren und dadurch an Volumen verlieren.
Betrifft das zum Beispiel auch BioOss?
Blume: Das gilt letztlich für alle partikulären Materialien, ob Hydroxylapatit oder Trikalziumphosphat.
Favorisieren Sie bei mechanischer Belastung autologe oder allogene Blöcke?
Smeets: Allogene, vor allem aufgrund der mechanischen Eigenschaften. Die Formkörper brechen nicht so leicht und lassen sich unkomplizierter anpassen. So lassen sich verschiedenste Geometrien anfertigen, entweder chairside oder bereits in der Gewebebank, die ohne größeres Frakturrisiko im Patienten eingesetzt werden können.
Wunddehiszenzen mit ausbleibender Knochenregeneration führen häufig zum Verlust des Augmentats – auch bei allogen Knochenblöcken?
Blume: Unserer Erfahrung nach kommt es bei der Augmentation mit allogenen Blöcken zu Wundheilungsstörungen, entsteht zwar eine Komplikation – der exponierte Knochen ist infiziert und wird nekrotisch –, aber der nicht exponierte Knochen, also der Knochen, der noch von Schleimhaut bedeckt ist, bleibt meist erhalten. Er wird ernährt, erwacht zum Leben und man kann fast immer implantieren, wenn man etwas nachaugmentiert. Ist dagegen ein autologer Knochenblock dehiszent, verliert man alles – nicht nur den Knochen, der freiliegt.
Kann die Schalentechnik davor schützen?
Smeets: Durchaus: Ich bin ein Fan der Schalentechnik nach Prof. Dr. Fouad Khoury, die die laterale und auch vertikale Begrenzung des Defekts darstellt und somit die Grenzen der Augmentation vorgibt. Prof. Khoury hat uns früh dargelegt, dass eine Augmentation mittels Schalentechnik besser durchbaut wird als ein autologer Knochenblock. Das Prinzip der Schalentechnik beruht darauf, einen biologischen Container zu schaffen, der ausreichend Freiraum für die vollständige Inkorporation der partikulären KEM gibt.
Worauf muss man bei der Schalentechnik besonders achten?
Smeets: Dass die kortikale Schale niemals zu nah am Implantat steht. Scharfe Kanten sollten zudem zum Beispiel mit einer Diamantkugel sorgfältig abgerundet werden. Ferner ist es wichtig, einen absolut spannungsfreien und speicheldichten Wundverschluss zu erzielen. Keinesfalls darf der Lappen an den Schrauben „scheuern“. Als Dehiszenzschutz empfehle ich eine Perikardmembran, die fixiert, also angenäht oder mit Pins fixiert werden sollte. Denn auch Mikrobewegungen ziehen Resorptionen nach sich.
Aber Sie arbeiten nicht wie Khoury mit autologen Platten …
Smeets: Nein, wir verwenden vorgefertigte Knochenplättchen aus Spenderknochen. Das Verfahren, also die Technik, ist identisch, doch die invasive Entnahme-OP entfällt. Da wir auch Fälle beobachteten, in denen diese Kortikalis nicht vollständig integriert wurde, findet eine Überaugmentation um die Breite des kortikalen Knochens statt. Nach Befestigung mit mindestens zwei Osteosyntheseschrauben wird der Spalt in der Mitte mit allogenem Granulat aufgefüllt. Das Verfahren ist relativ simpel und die Entnahmemorbidität entfällt komplett.
Setzen Sie überhaupt noch auf xenogenes oder autologes Material?
Smeets: Selbstverständlich, jedes Material hat seine Indikation. Es ist naiv zu glauben, mit einem Material jeden Defekt therapieren zu können. Das geht weder mit xenogenem noch autologem noch allogenem. Man muss individuell entscheiden, was besser ist. Die jeweilige Indikation hängt immer von vielen Faktoren ab:
- Wie viel vertikale Distanz habe ich im Sinuslift? Wie viel Restknochen ist da noch?
- Habe ich 7 bis 10 mm, mache ich keinen Sinuslift sondern setze kurze Implantate, habe ich 3 bis 6, dann entscheide ich mich für den externen Sinuslift und eine zeitgleiche Implantation.
- Sind nur 3 mm Restknochen vorhanden, plädiere ich für einen externen Sinuslift und eine sekundäre Implantation. Nicht nur die Wahl meines Materials, auch das Konzept und die Technik sind multifaktoriell.
Pauschal lässt sich das nicht beantworten?
Smeets: Nein, das verdeutlicht ein Review von 136 Studien über Sinusbodenelevationen mit autologem, allogenem, xenogenem und synthetischem KEM von Danesh-Sani aus dem Jahr 2017. Die umfassende Literaturanalyse zeigte:
- Nach weniger als 4,5 Monaten Einheilzeit erzeugt autologer Knochen die meiste Knochenneubildung,
- zwischen 4,5 und neun Monaten gibt es keine Unterschiede,
- nach mehr als neun Monaten erzielt allogenes KEM den meisten neugebildeten Knochen.
Wann würden Sie zum Beispiel für Titanmeshes plädieren? Welche Rolle spielt dabei die Defektgröße?
Back: Präfabrizierte Titanmeshes verwenden wir zum Beispiel nur bei überschaubaren vertikalen Defekten. Wir haben bislang zwölf Fälle mit vorfabrizierten Titangittern operiert. Die Meshes sind kostengünstiger als allogene Blöcke, können aber nach der Fertigung nicht mehr verändert werden. Das ist eventuell ein Nachteil.
Was ist das Problem?
Back: Sollte es bereits in der Einheilphase zu einer Resorption kommen, ist das nicht mehr zu korrigieren. Bis dato konnten wir diese Problematik aber noch nicht beobachten. Beim Einbringen allogener Knochenblöcke lässt sich eine mögliche Resorption durch eine Überaugmentation, die korrigiert wird, besser planen.
Wie funktioniert das exakt?
Back: Wir kalkulieren beim Design des allogenen Knochenblocks zu erwartende Resorptionen gleich mit ein und modellieren das Augmentat beim Einbringen intraoperativ. Das geht beim Titanmesh nicht. Man muss es so einsetzen, wie man es bekommt. Bei reizloser Einheilung läuft alles bestens, das Volumen unter dem Titangitter wird gehalten und schafft ein gutes Implantatlager. Bei größeren Defekten bevorzugen wir aber den allogenen Knochenblock. Dass sich Titangitter nicht nachmodellieren lassen, stellt durchaus einen Nachteil dar.
Smeets: Schwierig ist zudem das Weichgewebshandling. Ich rate dringend dazu, eine Kollagenmembran über das Titanmesh zu legen.
Buchbinder: Bei inhomogenen und schwer abzugrenzenden Knochenverhältnissen haben Meshes aber klare Vorteile gegenüber Auflagerungsplastiken, da Meshes unabhängig von der Oberflächenbeschaffenheit des Defekts nur basierend auf der gewünschten Kieferkontour konstruiert werden. Dies vereinfacht die Planung erheblich. Negativ zu beurteilen sind jedoch die Notwendigkeit der Entfernung und die hohe Rate an Expositionen, die von verschiedenen Quellen mit durchschnittlich 30 Prozent angegeben wird.
Eine Expositionsrate von 30 Prozent, das ist enorm. Wie kommt das? Und: Gilt das auch für die präfabrizierten?
Smeets: Ja, und die Expositionsraten treten auch bei versierten Operateuren auf. Meines Erachtens ist das auf das Material, den Fremdkörper, zurückzuführen, die Weichgewebsdeckung der oft großen Fläche ist problematisch. Wir testen zurzeit Gitter aus Magnesium, damit Meshes resorbierbar werden und nicht mehr entfernt werden müssen.
Kommen wir zu den allogenen Knochenringen: Das Charmante an dieser Technik ist ja, dass der Patient gleich das Implantat mitgeliefert bekommt …
Back: … und genau das bringt ein deutliches Risiko mit sich. Wir haben damit jedenfalls bis dato noch keine große Erfahrung gesammelt. Ich favorisiere ein Nacheinander: erst den Aufbau, dann die Implantation. Versagt nämlich der Knochenring – bei uns so geschehen –, verliert man gleich das ganze Implantat.
Seit Jahren macht sich die Arbeitsgruppe um Dr. Bernhard Giesenhagen stark für die Knochenringtechnik, inzwischen werden auch Allograftringe aus der Packung angeboten. Die Technik gilt als wenig invasiv und hat durchaus viele Anhänger. Ist sie tatsächlich praxistauglich?
Smeets: Nicht grundsätzlich. Die Technik hat durchaus ihre Indikationen, und wer sie beherrscht, kann super Ergebnisse erzielen, aber dazu bedarf es intensiven Trainings. Denn so einfach, wie es scheint, ist die Methode nicht. Um die Knochenringtechnik anwenden zu können, braucht es bestimmte Voraussetzungen hinsichtlich der Gestaltung des lokalen Knochenbetts. Vor allem aber fehlen Studien und Daten zu den Komplikationsraten und Indikationen. Und wie bei allen Augmentationsverfahren ist das Weichgewebsmanagement oft das Problem.
Herr Dr. Buchbinder, botiss bietet die allogenen Knochenringe an. Sind sie ein „Ladenhüter“?
Buchbinder: Gar nicht. In bestimmten Situationen ist die Technik super, etwa bei rein vertikalen Defekten in einer Einzelzahnlücke oder einzeitigen Sinusbodenelevationen mit minimalem Knochenangebot (1–3 mm) Auch nach Explantation periimplantär kompromittierter Implantate, die mittels Trepan entfernt werden müssen und anschließender Dekontamination des Areals, bietet der Einsatz allogener Knochenringe interessante Behandlungsoptionen.
Weniger invasiv als alle Augmentationen ist das Vermeiden der Knochenaufbauten. Mit kurzen und durchmesserreduzierten Implantaten wird das möglich. Ist das für Sie eine Option?
Smeets: Natürlich: Die Implantatdimensionen sollte man immer diskutieren. Vor allem erschließen wir uns mit durchmesserreduzierten und kurzen Implantaten neue Indikationen. So ist ein Implantat mit einem Durchmesser von 2,9 mm zum Beispiel eine elegante Lösung bei Aplasie eines 22. Reduzierte Implantatdimensionen machen aus einem komplexen aber niemals einen einfachen Fall …
Blume: … und sie ermöglichen nicht immer eine Augmentationsvermeidung. Beispiel: Kurze Implantate – unter 6 mm – sind im Frontzahnbereich klar kontraindiziert. Fehlt die vertikale Höhe, braucht es längere Kronen – ein No-Go im ästhetischen Bereich. Aber: Der Patient muss grundsätzlich über alle Alternativen zur Augmentation aufgeklärt werden.
Buchbinder: Das Verständnis von optimaler Implantat- zu Kronenlänge hat sich in den letzten Jahren stark gewandelt. Gerade bei großen vertikalen Defekten ist aber irgendwann aus funktionellen oder ästhetischen Gründen eine Grenze dessen erreicht, was ohne Augmentation zu bewältigen ist. Bei den durchmesserreduzierten Implantaten sollte natürlich nicht nur die Primärstabilität berücksichtigt, sondern es sollten immer auch die altersbedingten Dimensionsveränderungen des Alveolarknochens in Betracht gezogen werden. Um den dünnen Kieferkamm zu stabilisieren, könnte zum Beispiel nach dem Einsetzen dünner Implantate eine Konturierung mit resorptionsstabilem bovinem KEM für Langzeitstabilität sorgen.
Im Gegensatz zu kurzen und durchmesserreduzierten Implantaten ist die Stu‧dienlage zur Anwendung von Allografts recht dünn. Gleichzeitig gibt es viele Vorurteile. Wie gehen Sie damit um?
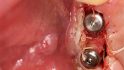
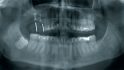
Blume: Zu Allografts gibt es bereits einiges an Studien, mit Blick auf die CAD/CAM-gefertigten sieht es noch mau aus. Wir haben fast 70 Knochenblöcke in den letzten fünf Jahren eingebracht und sind selbst überrascht, wie stabil das Volumen der allogenen Blöcke geblieben ist, insbesondere was die vertikale Höhe angeht. Und das ist für uns auch eins der Hauptargumente, warum wir diese Augmentationsmethode so empfehlen. Ein solche Konstanz in der Vertikalen bieten andere Knochenersatzmaterialien nicht.
Also auch nicht der Eigenknochen?
Smeets: Dazu ist die Datenlage leider dünn. Aber zum Beispiel belegt die Studie von Monje und Kollegen aus 2014 zum Knochenaufbau vor Implantation im atrophen Oberkiefer in 15 Arbeiten mit 361 Knochenblöcken (follow up 4–9 mo post-op), dass Allografts eine zuverlässige Alternative zum autologen Knochen mit geringerer Hebedefektmorbidität und OP-Zeit sind. Nissan und Kollegen haben 2011 gezeigt, dass auch beim Knochenaufbau vor Implantation im atrophen Unterkiefer Allografts eine sichere und zuverlässige Alternative zum autologen Knochen darstellen.
Und im Gegensatz zum Eigenknochen ist das Protokoll extrem praxistauglich und beinahe simpel. Der DICOM-Datensatz des Defekts wird generiert und an den Hersteller gesendet, der die allogenen Knochenblöcke wunschgemäß fräst und an die Praxis schickt. Beachtet der niedergelassene Kollege die Vorgaben – keine scharfen Kanten, die richtige Distanz zu den Nachbarzähnen, Schrauben versenken, damit die nicht scheuern am Weichgewebe, den Lappen korrekt applizieren, mit Membranen arbeiten –, kann kaum etwas schiefgehen. Ferner ist es wichtig, zur Deckung eine Kollagenmembran und als Abschluss die Fibrinmembran (PRF) zu verwenden. Bitte frühestens nach vier Monaten implantieren. Je größer der Defekt (ab 3–5 mm vertikal im UK sechs Monate!) ist, desto länger warte ich (ist auch abhängig vom AZ: bei Rauchern und Diabetikern warte ich auch länger).
Sind noch andere Studien auf dem Weg?
Blume: Habe ich zumindest noch nicht mitbekommen. Wir arbeiten jedenfalls intensiv an der Aufbereitung unsere Fälle. Wir haben inzwischen auch vielversprechende Histologien.
Herr Dr. Buchbinder, warum ist die Studienlage lückenhaft?
Buchbinder: Aufgrund der strengen regulatorischen Auflagen gibt es nur wenige in vielen Ländern gleichzeitig, dafür aber häufig nur lokal verfügbare Produkte. Dadurch werden multizentrische und große epidemiologische Studien erschwert. Zum anderen sind aufgrund der hohen Produktionskosten und der geringen Überschüsse die finanziellen Mittel der Industrie häufig begrenzt. Die Gewebebanken operieren ohnehin gemeinnützig und sind von sich aus nicht in der Lage große Studien zu initiieren. Hinzu kommt, dass der Erfolg gerade der komplexeren Operationen sehr stark von den chirurgischen Fähigkeiten und den Präferenzen des Behandlers abhängt, wodurch ein Vergleich verschiedener Operationstechniken nie objektiv erfolgen kann, sondern sehr stark subjektiv geprägt ist; dies gilt übrigens auch für autologe Knochenblöcke (Motamedian, Khojasteh, Khojasteh, 2016). Die hervorragenden Ergebnisse niedergelassener Ärzte tauchen meist nur als Fallbeispiele oder Fallserien auf, da ganz klar das Know-how und die Ressourcen fehlen, groß angelegte Studien aufzusetzen und durchzuführen. Im universitären Bereich fehlen aber häufig die Patientenzahlen bzw. die klinische Routine mit den Techniken, sodass in Zukunft eine stärkere Verzahnung der Universitäten mit privat praktizierenden Behandlern wünschenswert wäre.
Smeets: Über allogene Blöcke gibt es zahlreiche Literatur, nur bei den präfabrizierten sieht es mager aus.
Liegt das auch an den Vorurteilen gegenüber Spenderknochen? Gibt es heute eventuell doch noch eine Gefährdung?
Buchbinder: Eine reale Gefährdung von Patienten durch die bloße Anwendung von Allografts ist schon lange nicht mehr gegeben, geschweige denn derzeit belegt. Vereinzelte Fälle von Krankheitsübertragungen sind möglicherweise auf unzureichende diagnostische Methoden und die Verwendung von nicht sterilisierten Geweben in der Vergangenheit zurückzuführen (Hinsenkamp et al., 2012). Dank der weltweiten Beobachtung von Zwischenfällen und der enormen Fortschritte im Tissue-Banking ist inzwischen lediglich noch von einem theoretischen Restrisiko die Rede, etwa durch noch nicht beschriebene Krankheiten. Es gibt tatsächlich weltweit keine bestätigten Fälle von Krankheitsübertragungen durch chemisch aufbereitete und gammabestrahlte Knochenpräparationen von getesteten Spendern, wie sie in Deutschland zum Einsatz kommen. Berichte über mögliche Antigenität und daraus resultierende mögliche Komplikationen bei späteren Organtransplantationen sind als Einzelfälle für fresh-frozen (O’Sullivan, 2016) bzw. kryokonservierten Knochen beschrieben (Mosconi et al., 2009). Tatsächlich gibt es für den Einsatz in der Orthopädie in Amerika mittlerweile mehrere FDA-registrierte Präparate, in denen aufbereitete Knochenallografts sogar kombiniert werden mit isolierten allogenen lebenden osteogenen Zellen desselben Spenders (z. B. Vivigen, Life Net Health, Virginia Beach), um schwer heilende Frakturen zu behandeln.
Der Patient muss sich also heute also keine Gedanken über mögliche Krankheitsübertragungen machen?
Smeets: Nein, in den 70er-, 80er- und 90er-Jahren haben sich die Menschen angesteckt, weil die Untersuchungsmethoden noch nicht so weit waren. Seit Einführung des sogenannten NAT-Screenings (Nucleic Acid Test) wurden keine Vorfälle verzeichnet. Bei zum Beispiel mehr als 250 000 allogenen Transplantaten aus der Charité, die zwischen 1994 und 2015 gesetzt wurden, gab es keine einzige Infektion, keinen einzigen Verdacht auf eine virale oder bakterielle Infektion. Alle Produkte sind prozessiert, desinfiziert und sterilisiert worden; das ist der entscheidende Punkt. Dennoch muss der Patient über ein theoretisches Restrisiko aufgeklärt werden.
Herr Dr. Blume, Herr Dr. Back, wie klären Sie in Ihrer Praxis auf?
Blume: Wir verwenden mit Allografts Produkte, die in Deutschland nach dem Arzneimittelgesetz zugelassen sind. Wir können davon ausgehen, dass diese Produkte intensiv getestet wurden und sicher sind. Das stelle ich als Kliniker nicht infrage. Und das erkläre ich auch meinen Patienten.
Welchen Stellenwert haben Allografts in der Zahnmedizin im weltweiten Vergleich?
Buchbinder: Allografts sind in vielen Ländern der Welt das am meisten genutzte Knochenersatzmaterial, nicht zuletzt in den USA. Je nach Land nehmen Allografts im dentalen Bereich 35–40 Prozent des Gesamtmarkts ein, während synthetische Materialien nur einen Anteil von ca. 15–20 Prozent einnehmen (Straumann Group 2016 Annual Report). Geschätzt werden bei Allografts besonders das gute Handling, das hohe Remodellingpotenzial und die im Vergleich zu bovinen und synthetischen Materialien schnellere Knochenbildung (Schmitt et al., 2012).
Blume: Allografts haben heute aufgrund der CAD/CAM-Vorfertigung einen ganz anderen Stellenwert bekommen. Das ist natürlich etwas, was wir mit autologem Knochen nicht machen können. Wir können nicht, während der Patient am Beckenkamm operiert wird, das Stückchen gleich in eine Fräsmaschine stecken. Das funktioniert derzeit nur mit dem allogenen Knochenblock. Wie attraktiv das ist, merken wir, da wir „aus aller Herren Länder“ Einladungen bekommen, darüber zu referieren.
Smeets: Allogene Materialien gehören zu den Standardmaterialien in den USA. Deutschland wird nachziehen, davon bin ich überzeugt. Immer mehr Fallstudien zeigen, wie gut die Materialien sind. Sie haben eine sehr gute poröse Oberfläche, sie stammen vom humanen Körper, die Entnahmemorbidität entfällt. Allogene Materialien sind den synthetischen klar überlegen, das ist belegt. Und: Materialien tierischen Ursprungs stoßen auf immer mehr Ablehnung. Dennoch muss über das Restrisiko detailliert aufgeklärt werden.
Kann Eigenknochen angesichts der aktuellen Entwicklungen heute noch als Goldstandard eingestuft werden?
Blume: Nein, als Goldstandard kann man Eigenknochen heute nicht mehr betrachten.
Was ist Ihrer Ansicht der neue Goldstandard?
Blume: Der einzige Goldstandard, den es gibt, lautet: bei jedem Patienten neu über das Therapiekonzept nachdenken und ihm die Alternativen erläutern.
Die Experten:
Dr. Dr. Dr. Oliver Blume M.Sc. befasst sich seit mehr als 25 Jahren mit Knochenersatzmaterialien. Der Oralchirurg ist niedergelassen in der Partnerschaftsgesellschaft Dr. Back & Dr. Blume in München. praxis@backundblume.de
Uni.-Prof. Dr. Dr. Ralf Smeets, Leiter der Sektion für „Regenerative Orofaziale Medizin“, Leiter der Forschung, Geschäftsführender Oberarzt der Klinik und Poliklinik für MKG-Chirurgie, Universitätsklinikum Hamburg-Eppendorf. r.smeets@uke.de
Dr. Benno Buchbinder ist improvierter Biologe und seit Januar 2016 Head of Product Management Allograft bei der botiss medical AG, Berlin. Zuvor war er Produktmanager bei der botiss biomaterials GmbH. Benno.Buchbinder@botiss.com
Dr. Michael Back M.Sc. studierte Zahnmedizin in Erlangen-Nürnberg und ist niedergelassen in der Partnerschaftsgesellschaft Dr. Back & Dr. Blume in München. praxis@backundblume.de