Schutz vor Periimplantitis
Kann die regelmäßige Anwendung von Implantat-Pflege-Gel das Periimplantitis-Risiko wirksam senken? Ja, meint Dr. Eleonore Behrens von der Universität Kiel. Sie befasst sich seit Jahren mit der Thematik und hat in der Universitätsklinik Kiel entsprechende Studien durchgeführt.
In einer Literaturübersicht von Mombelli et al. aus dem Jahr 2012 wurden insgesamt 29 Studien zum Entstehungsrisiko von Periimplantitis beurteilt. Dabei zeigte sich, dass bei 10 Prozent aller gesetzten Implantate und bei 20 Prozent der Patienten innerhalb von fünf bis zehn Jahren periimplantäre Entzündungen auftraten (Mombelli et al. 2012). Sind diese Angaben nach wie vor aktuell? Auf jedem Kongress werden andere Zahlen genannt.
Behrens: Mombellis Aussagen von 2012 haben nach wie vor ihre Gültigkeit. Aber in der Tat gibt es unterschiedliche Angaben. In der Literatur geht man heute von einer Periimplantitisprävalenz von 12 bis 43 Prozent aus.
Eine enorme Spannbreite …
Behrens: Das ist richtig. Sie ist zurückzuführen auf eine schwedische Studie, die eine Prävalenz von 43 Prozent beschreibt. Involviert waren zirka 8.000 Zahnärzte. Wir in Kiel halten 43 Prozent für sehr hoch. Aufgrund der enormen Datenmenge muss die Studie aber berücksichtigt werden. Sie wird auch nach wie vor zitiert.
Wie ist das zu erklären? Spielen die jeweils verwendeten Implantatsysteme dabei eine Rolle?
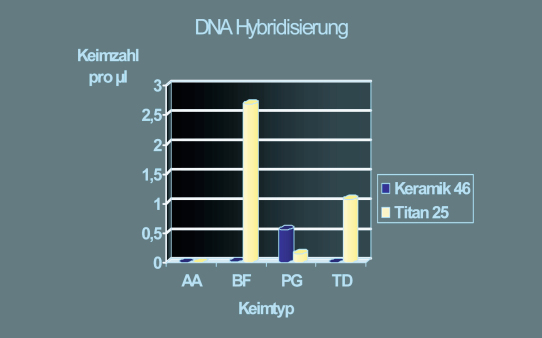
Behrens: Meines Wissens hat keine Studie explizit untersucht, ob ein bestimmtes Implantatsystem periimplantäre Entzündungen fördert oder hemmt. Allerdings wurden die Implantatoberflächen unter die Lupe genommen. Parameter wie Oberflächenrauigkeit und chemische Zusammensetzung haben nachweislich einen signifikanten Einfluss auf die Biofilmbildung und damit wohl auch auf die Entstehung einer periimplantären Entzündung. Raue Implantatoberflächen ziehen Plaque an, je glatter die Oberfläche, desto geringer die Adhärenz der Plaque. Auf den glatteren Oberflächen von Keramikimplantaten findet sich zum Beispiel weniger Plaque als auf Titanoberflächen (Weng 2014).
Ist der Trend zur maschinierten Implantatschulter eine Folge dieser Erkenntnis?
Behrens: Jedenfalls gelten maschinierte Schultern, also hochpolierte Oberflächen, als plaqueabweisend. Vergleichende Langzeituntersuchungen stehen dazu allerdings noch aus. Selbstverständlich führen nicht nur raue Oberflächen zur Entstehung von Mukositis bzw. Periimplantatitis, sondern auch Faktoren wie insuffiziente Mundhygiene, Nikotinab¬usus, Medikamenteneinnahme, genetische Disposition, Diabetes oder Strahlentherapie im Rahmen einer Tumorbehandlung.
Gibt es einen typischen Periimplantitiszeitpunkt, häufen sich die Komplikationen zum Beispiel fünf bis zehn Jahr nach der Insertion?
Behrens: Davon hört man zwar immer wieder, aber es fehlt an Evidenz. Schließlich verlaufen periimplantäre Infektionen unterschiedlich.
Inwiefern?
Behrens: Man unterscheidet zunächst einmal zwischen der entzündlichen Veränderung im periimplantären Weichgewebe ohne Knochenverlust, der Mukositis und der fortschreitenden Entzündung und Taschenbildung mit Knochenverlust, der Periimplantitis. Eine Mukositis ist quasi das Pendant zur Gingivitis, die Periimplantitis das Pendant zur Parodontitis. Allerdings ist die Progredienz der Destruktion in Weichgewebe und Knochen an Implantaten ausgeprägter als an natürlichen Zähnen, da sich die Entzündung direkt bis zum Knochen ausbreitet und nicht wie bei der Parodontitis zirka 1 mm vom krestalen Knochen entfernt bleibt, da der natürliche Zahn durch die Desmodontalfasern geschützt ist.
Wie unterscheiden sich die klinischen Anzeichen?
Behrens: Auf den ersten Blick kaum. Sowohl bei der Mukositis als auch bei der Periimplantitis treten zunächst Rötungen, Schwellungen, Blutung auf Sondierung mit oder ohne Pusaustritt usw. auf. Aber, und das ist der große Unterschied, nur wenn auch ein irreversibler Knochenabbau in der Röntgendiagnostik nachzuweisen ist, sprechen wir von der Periimplantatitis. Ist nur das Weichgewebe in Mitleidenschaft gezogen, handelt es sich um die Mukositis.
Die Röntgendiagnostik ist also ein Muss?
Behrens: Ja, nur so lässt sich nachweisen, ob es sich um eine Periimplantitis oder eine schwere Mukositis handelt. Diese Unterscheidung ist für die Therapie wichtig.
Welche Meinung vertreten Sie?
Kontrovers diskutiert wird das Für und Wider des Sondierens am Implantat. Was vertreten Sie?
Behrens: Es ist zwingend erforderlich. Ob eine Tasche drei, vier oder zehn Millimeter misst, ist schließlich therapieentscheidend. Jede wissenschaftliche Studie stützt sich auf den Parameter „Sondierungstiefe“ bei der Erhebung des klinischen Befundes.
Was kann schiefgehen?
Behrens: Die sogenannte fibrilläre Faserstruktur, mit der das Implantat im Knochen verankert ist, darf auf keinen Fall verletzt werden. Sondierungsgegner fürchten, dass zu grobes Sondieren Infektionen am Implantat erst hervorruft.
Sie denn nicht?
Behrens: Nein, aber es ist Vorsicht geboten, der Sondierungsdruck sollte unter 25 N liegen.
Perfekte Mundhygiene und die hygienefähige Gestaltung von Suprakonstruktionen schützen bekanntlich nicht per se vor Mukositis bzw. Periimplantitis …
Behrens: … und deshalb ist der regelmäßige Recall so wichtig. Nur dann lassen sich rechtzeitig zusätzliche präventive Maßnahmen ergreifen. Risikopatienten, Raucher, Diabetiker, Tumorpatienten unter Bestrahlung oder auch Bisphosphonatpatienten, sollten mehrfach pro Jahr untersucht werden.
Wie häufig?
Behrens: Die Freqenz des Recalls sollte vom Befund des Patienten abhängen. Ein parodontal vorgeschädigter Patient unterliegt nach vorangegangener Therapie dem gleichen Risiko, eine periimplantäre Mukositis/Periimplantitis zu entwickeln, wie ein „gesunder“ Patient. Bei einer vorangegangenen aggressiven Parodontitis der Restbezahnung sollte man engmaschigere Kontrollen als halbjährliche wählen, da das Risiko der periimplantären Inflammation erhöht ist (Heitz-Mayfield et al. 2010)
PA-Patienten, die ein Implantat erhalten, gelten als besonders periimplantitisgefährdet, warum?
Behrens: Als Ursachen einer Periimplantitis gelten Plaque und mangelnde Mundhygiene, aber auch prädisponierende Faktoren wie Rauchen (Heitz-Mayfield et al. 2009), ein schlecht eingestellter Diabetes mellitus (Tonetti und Schmid 2000) und ein positiver Interleukin-1-Genotyp (Lin et al. 2007) sowie vorangegangene Parodontopathien (Karoussis et al. 2003). Im Gegensatz zu parodontal verankerten Zähnen entspricht der periimplantäre Abschluss zur Mundhöhle eher einer bindegewebigen Narbe. Sie besitzt fast ausschließlich vertikale Bindegewebsfasern (Abrahamsson et al. 1996). Durch die Avaskularität ist die Immunabwehr reduziert. Wie von Laurisch et al. 2011 beschrieben, nimmt die parodontale Gesundheit der Restbezahnung Einfluss auf die Osseointegration: Im parodontal vorgeschädigten Gebiss ist ein später Implantatverlust oder eine Periimplantitis häufiger als im nicht vorgeschädigten Gebiss. Es ist also erforderlich, dass eine bestehende Parodontitis vor einer Implantatinsertion therapiert wird. Wird diese Therapie nicht durchgeführt, kann durch intraorale Kolonisation parodontopathogener Mikroorganismen der Langzeiterfolg der Implantate gefährdet sein.
Inwieweit unterscheidet sich die klinische Diagnostik von Periimplantitis und Parodontitis? Gelten die gleichen Regeln wie bei der Parodontitis?
Behrens: Bei der klinischen Diagnostik der Periimplantitis werden prinzipiell die gleichen Parameter wie in der klinischen Diagnostik der Parodontitis erhoben. Dies sind: Plaqueakkumulation, Rötung und/oder Schwellung der Gingiva, Blutung auf Sondieren und die Sondierungstiefe. Taschenmessungen, die von der Implantatschulter aus gemessen tiefer als 4 mm sind, gelten als pathologisch und sind ebenso wie ein positiver BOP oder das Auftreten einer eitrigen Sekretion bei Sondierung ein sicheres Indiz für eine Entzündung (Heasman et al. 2010).
Für die Erhebung dieser Parameter wurden verschiedene für die Parodontitis angewandte Indizes modifiziert und auf die marginale Situation bei Implantaten angepasst, wie zum Beispiel die modifizierten Plaque- und Gingivaindizes nach Mombelli oder der modifizierte Gingiva¬index nach Apse et al. (Schwarz und Becker 2007, Mombelli und Lang 2000). Die Aussagekraft dieser Parameter in der Diagnostik der Periimplantitis und in der Diagnostik der Parodontitis ist nahezu identisch (Heitz-Mayfield 2008).
In verschiedenen Studien konnte durch mikrobiologische Untersuchungen belegt werden, dass das für die Periimplantitis verantwortliche Keimspektrum sich nicht von dem für die Parodontitis verantwortlichen Keimspektrum unterscheidet (Schwarz und Becker 2007, Heitz-Mayfield et al. 2010). Als Leitkeime der Periimplantitis gelten hauptsächlich Actino¬bacillus actinomycetemcomitans, Porphyromonas gingivalis, Prevotella intermedia, Bacteroides forsythus und Treponema denticola, da diese in ausgeprägten periimplantären Taschen mit fortgeschrittenem Knochenabbau quantitativ am dominantesten sind (Quirynen et al. 2005, Lin et al. 2007).
Unterschiede
Wo liegen die Unterschiede?
Behrens: In der prozentualen Verteilung der Bakterienarten: Die Anzahl anaerober Aktinomyzeten und Spirochäten ist bei der Periimplantitis deutlich höher als bei der Parodontitis (Conrads 1999). Vom Orde et al. beschreiben auch auf molekularbiologischer Ebene deutliche Differenzen zwischen den beiden Erkrankungen. Ihre Auswertung ergab, dass Periimplantitis und Parodontitis unterschiedliche Expressionsmuster bestimmter Kollagene der extrazellulären Matrix sowie deren abbauender Enzyme aufweisen (vom Orde et al. 2011).
Eine Untersuchung von Häsler et al. 2011, in der Gingivagewebeproben von Periimplantitispatienten sowohl mit Proben von Parodontitispatienten als auch mit Proben von gesunden Patienten verglichen wurden, zeigte klare Abweichungen zwischen der mRNA des Gingivagewebes bei Periimplantitis und Parodontitis. Sicher gibt es auf molekularbiologischer Ebene noch weiteren Forschungsbedarf, zumal damit auch eventuell Präventionsmöglichkeiten etabliert werden könnten (Becker et al. 2012).
Eickholtz definiert folgende Faktoren als Risiko für Zahnverlust: mangelhafte Mundhygiene, unregelmäßiges Erscheinen zur Nachsorge, Interleukin-1-positiver Genotyp, Rauchen, fortgeschrittenes Alter und Art der vorhandenen Parodontitis, wobei für aggressive und chronische Parodontitis ein im Vergleich zur moderaten Parodontitis doppelt so hohes Risiko beschrieben wird. Diese Risikofaktoren gelten für die Periimplantitis ebenso wie für die Parodontitis (Eickholtz et al. 2008, Heitz-Mayfield 2010, Sahm u. Becker 2011).
Im Gegensatz zur Parodontitis handelt es sich bei der Periimplantitis immer um eine lokale Ostitis, da es, anders als an natürlichen Zähnen, an Implantaten kein Parodontium gibt, das eine immunkompetente Schutzfunktion besitzt, und die Entzündung sehr viel schneller von der Gingiva auf den Knochen übergreift (vom Orde et al. 2011).
Ist eine Mukositis bereits fortgeschritten oder handelt es sich um eine beginnende Periimplantitis, kommt die Implantoplastik ins Spiel. Sie ist nicht unumstritten und wird auch als Fünf-vor-zwölf-Maßnahme beschrieben …
Behrens: Für mich stellt die Implantoplastik definitiv keine Fünf-vor-zwölf-Maßnahme dar! Diese Glättung und Reinigung der Implantatoberfläche mit rotierenden Instrumenten, Laser, Ultraschall oder Pulverstrahl sowie anschließender Dekontamination mit Phosphorsäure oder CHX zählt bei uns in Kiel zum absoluten Standard. Mit diesen vergleichsweise einfachen Mitteln lässt sich sehr viel erreichen, etwa bei einer schweren Mukositis mit Sondierungstiefen von 6 mm oder auch einer beginnenden Periimplantitis (Schwarz et al. 2005, Romanos 2009).
Wo sehen Sie die Grenzen der Implantoplastik?
Behrens: Es gibt im Grunde nur eine Grenze: Bei irreversiblen Knocheneinbrüchen braucht es gegebenenfalls zusätzlich die regenerative Therapie.
Antibiotika gegen periimplantäre Entzündung
Welche Rolle spielen lokale Antibiotika beim Kampf gegen periimplantäre Entzündungen?
Behrens: Bei uns in Kiel keine, wir halten uns da extrem zurück.
Warum?
Behrens: Weil lokalen Antibiotika die spezifische Wirkgruppe fehlt. (Behrens, 2014). Die Resistenzbildung ist damit einfach zu hoch. Bei Pusaustritt und Persistenz der Entzündung ist ein Breitspektrumantibiotikum (Aminopenicillin, 500 mg 3/d 7d), Metronidazol (250 mg 2/d 7d) oder ein spezifisches Medikament nach Antibiogramm systemisch zu verordnen (Mombelli und Lang 2000). Ansonsten setzen wir aufs „Spülen und Salben“ sowie auf die mechanische Reinigung, zunächst einmal konservativ, ohne Abklappen.
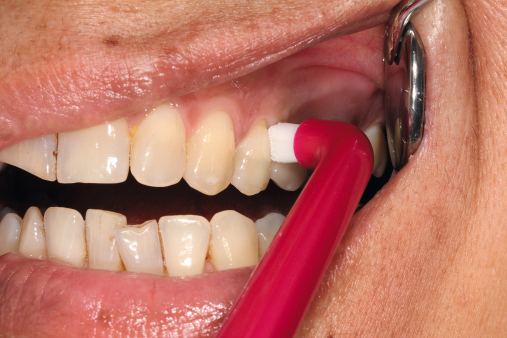
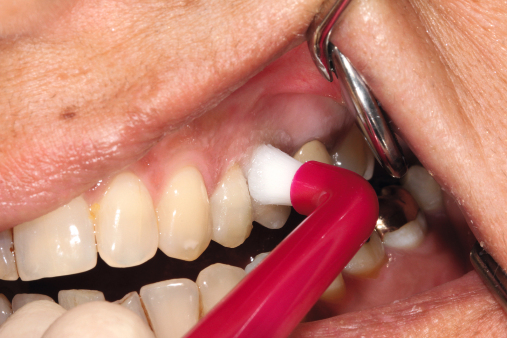
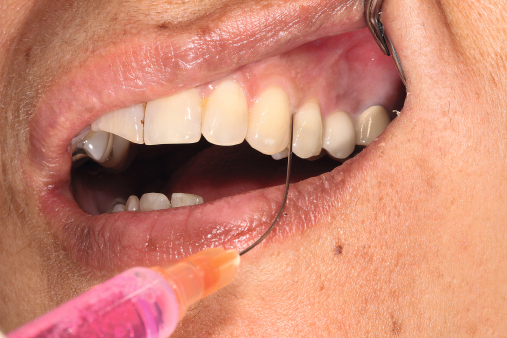
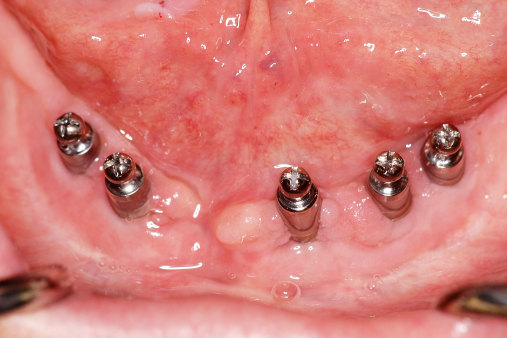
Da die Ätiologie der Periimplantitis auf einer bakteriellen Infektion basiert, sollte die Prävention bei der optimalen Mundhygiene beginnen. Diese sollte regelmäßig reevaluiert und gegebenenfalls korrigiert werden. Der Patient sollte eigenständig nach detaillierter Instruktion die mechanische Reinigung mit den entsprechenden Hilfsmitteln (Interdentalbürstchen, Zahnseide etc.) durchführen können (Neuschl et al. 2011). Unterstützt wird dies durch eine gründliche Scaling- oder Kürettagebehandlung mit anschließender Politur, zum Beispiel mit REMOTimplant (lege artis) im Rahmen der professionellen Zahnreinigung. Spülungen mit lokal desinifizierenden Lösungen, wie beispielsweise Paroex, und Prophylaxe mit Gelen wie durimplant (lege artis, Abb. 3) sind zur antimikrobiellen Wirkung anzuwenden (Behrens 2009). Ein regelmäßiger Recall wird in jedem Fall empfohlen (Abb. 5 und 6). Bei einem ausgedehnten Entzündungsbefall sollten zusätzlich dreimal wöchentliche Taschenspülungen (Abb. 4) vorgenommen werden.
2009 haben Sie in Kiel eine Periimplantitissprechstunde etabliert. Was steht im Fokus, die Prävention oder die Behandlung einer bereits bestehenden Periimplantitis?
Behrens: Ganz klar die Behandlung der periimplantären Entzündung. Wir haben diese Sprechstunde mit Blick auf die demografische Entwicklung etabliert. Unsere Patienten werden immer älter, wir implantieren immer häufiger immer mehr Implantate. Das führt natürlich auch zu einem Anstieg des Periimplantitisrisikos. Mit dieser Sprechstunde möchten wir auch eine Anlaufstelle für betroffene Patienten niedergelassener Kollegen sein. Wer die klinischen Anzeichen hat, wird überwiesen. Wir klären ab, ob es sich um eine Mukositis oder eine Periimplantitis handelt. Sehe ich in meinem eigenen Recall entsprechende Anzeichen, lade ich diese Patienten ebenfalls zur jeweiligen Therapie in unsere Periimplantitissprechstunde ein.
Mit Prävention hat diese Sprechstunde also nichts zu tun?
Behrens: Nein, präventive Maßnahmen starten bereits bei der Implantatplanung. Da klären wir, welche konservativen, welche parodontalen Vorbehandlungen indiziert sind, ob extrahiert werden muss, welcher Zahnersatz den manuellen und visuellen Fähigkeiten des jeweiligen Patienten entspricht etc. Wir treffen die Entscheidung, ob festsitzend oder besser abnehmbar versorgt wird, um dem Patienten die Mundhygiene zu erleichtern.
Implantat-Pflege-Gels durimplant (lege artis)
Ihrem Periimplantitisengagement ging 2008 eine Pilotstudie zur Anwendung des Implantat-Pflege-Gels durimplant (lege artis) voraus. Untersucht wurden 48 Patienten, 226 Implantate, die Ergebnisse ließen hoffen. Setzen Sie seither das Pflegegel nach wie vor in Ihrer Klinik ein?
Behrens: Ja, und das nicht nur zur Pflege: Seit 2009, also seit wir die Periimplantitissprechstunde ins Leben gerufen haben, erhalten unsere Patienten durimplant auch abends präoperativ als konservative Vorbehandlung, wenn eine OP indiziert ist.
Wie darf man sich das vorstellen?
Behrens: Im ersten Schritt beurteilen wir die Suprakonstruktion hinsichtlich der Hygienefreundlichkeit. Liegt ein Entzündungsherd vor, behandeln wir konservativ wie oben beschrieben. Sind die Entzündungszeichen reduziert, empfehlen wir tägliche Mundspülungen, zwei bis dreimal am Tag mit CHX sowie die abendliche Applikation von durimplant. Dann kontrollieren wir das Ganze zwei bis drei Wochen später und wägen ab, ob wir schon eine Operation, also die Implantoplastik, und/oder regenerative Therapie durchführen sollen.
Applizieren die Patienten das Implantat-Pflege-Gel selbst?
Behrens: Ja, das ist auch sehr einfach. durimplant wird auf ein Wattestäbchen oder ein Interdentalbürstchen aufgebracht und auf das feuchte Zahnfleisch um das Implantat herum oder auf eine entzündete Stelle appliziert und leicht einmassiert. Die Anwendung kann abends nach dem Zähneputzen bis mehrmals täglich erfolgen. Unsere Patienten erhalten entsprechende Proben und eine Empfehlung für den Hauszahnarzt. Zudem präsentiere ich durimplant auf meinen Fortbildungsveranstaltungen bei der Zahnärztekammer als Pendant zum Elmex-Gelee, den man einmal pro Woche anwendet, um den Zahnschmelz stabil zu erhalten.
Gibt es auch Langzeitdaten?
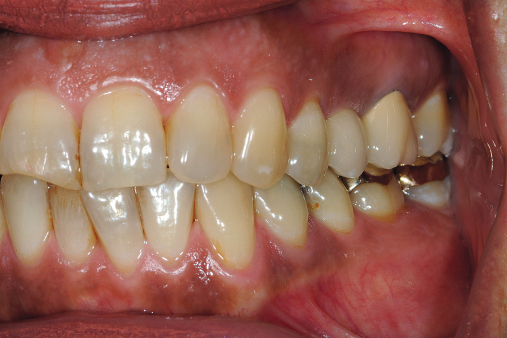
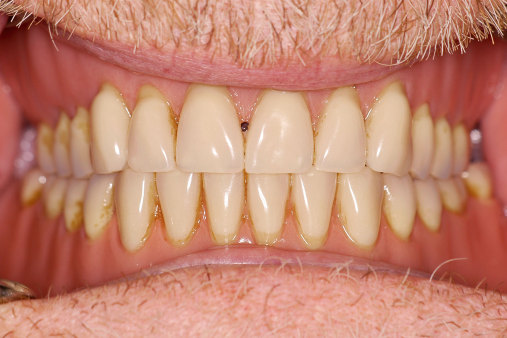
Behrens: Wir werden Ende des Jahres unsere Fünfjahresergebnisse der durimplant-Pilotstudie publizieren. Fast alle der damals teilnehmenden Patienten nehmen seit 2009 bis heute das Implantat-Pflege-Gel und sind nach wie vor in unserem Recall. Kein Patient hatte die Studie abgebrochen. Bereits nach einer Anwendungsdauer von sechs Monaten zeigten sich im Patientenkollektiv positive Ergebnisse. Die Fünfjahresdaten haben die positive Wirkung des Gels nun auch für die Langzeitanwendung bestätigt. Und: durimplant scheint auch eine therapeutische Wirkung zu entfalten: Einer meiner langjährigen Patienten, dem vor 22 Jahren seine Implantate inseriert wurden und der seit 2009 regelmäßig durimplant verwendet, hat im Anschluss an eine Unterfütterung seiner Prothese eine Druckstelle bekommen. (Abb. 7–9). Er meldete sich, und ich empfahl ihm, täglich durimplant zu applizieren. Nach einer Woche war keine Druckstelle mehr zu sehen. Es bleibt also spannend.

Dr. Eleonore Behrens
ist seit 1992 im Universitätsklinikum Schleswig-Holstein, Campus Kiel, tätig, zunächst als wissenschaftliche Mitarbeiterin, ab 1995 als Oberärztin der Klinik für Zahnärztliche Prothetik, Propädeutik und Werkstoffkunde. 1999 wechselte sie zur Klinik für MKG-Chirurgie. Zudem ist sie als Referentin mit dem Schwerpunkt Implantologie (DGI/APW, International Curriculum Implantology Kiel) und als Autorin national und international aktiv. Für ihr Engagement erhielt sie auf der 7. Gemeinschaftstagung der DGI, ÖGI und SGI in Wien die DGI-Verdienstmedaille.