So gelingt die Unterkiefer-Augmentation mit Titanmesh
In mehr als 97 Prozent der Fälle kommt in Deutschland bei der zahnärztlichen Lokalanästhesie Articain zum Einsatz [1] – ohne Adrenalin oder mit den Zusätzen 1:400.000, 1:200.000 sowie 1:100.000. Doch welche Konzentration ist wann sinnvoll? In dieser Reihe werden drei Patientenfälle vorgestellt. Eine Tabelle zeigt „Standardindikationen“ für die Konzentration auf und hilft bei der individuellen Auswahl des Anästhetikums. Ein Fall für 1:100.000 – die Augmentation.
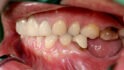
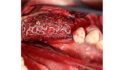
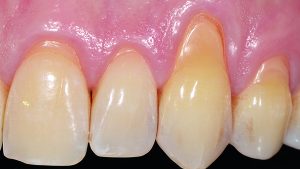
Abb. 1 Im linken posterioren Unterkiefermolarenbereich bestand eine Freiendsituation, das vertikale Defizit war mit bloßem Auge zu erkennen. Schon bei Palpation konnte der spitz zulaufende Kieferkamm erahnt werden. © Kämmerer
Im Universitätsklinikum Mainz stellte sich eine 62-jährige Patientin mit dem Wunsch nach festsitzendem Zahnersatz im linken posterioren Unterkiefer vor. Die Anamnese war unauffällig, die Patientin hatte keinerlei Vorerkrankungen und nahm keine Medikamente ein. Bei der klinischen Untersuchung war jedoch deutlich ein vertikales Knochendefizit mit 3 – 4 mm Restknochenhöhe über dem Verlauf des Nervus alveolaris inferior zu erkennen. Insbesondere stellte sich der residuale Alveolarknochen als spitz zulaufend und so als nicht für die primäre Insertion zahnärztlicher Implantate geeignet dar (Abb. 1 und 2), was also eine Unterkiefer-Augmentation erforderte.
Planung der Unterkiefer-Augmentation
Um dem Wunsch der Patientin nach festsitzendem Zahnersatz nachzukommen, musste prä implantationem Knochen aufgebaut werden. Nach eigenen Erfahrungen hat sich in solchen Fällen die Augmentation mittels Titanmesh bewährt [2]. Die Operationszeit ist etwas kürzer und das Ergebnis vorhersehbarer als bei einer „normalen“ Augmentation via Block- oder Guided Bone Regeneration (GBR-Techniken). Das Titanmesh (Yxoss CBR, ReOss GmbH, Filderstadt) wurde auf Basis der CAD-Planungsdaten des DVT-Datensatzes patientenindividuell hergestellt, sodass es am OP-Tag passgenau eingebracht werden konnte.
Schmerzmanagement
Etwa eine Stunde vor dem Eingriff erhielt die Patientin 600 mg Ibuprofen als präemptive Analgesie sowie eine präoperative orale Antibiose von 1 g Amoxicillin. Für die Operation war eine suffiziente Schmerzausschaltung der kompletten linken Unterkieferhälfte für circa 90 Minuten erforderlich.
Somit war die Leitungsanästhesie des N. alveolaris inferior indiziert. Da in 75 Prozent der Fälle der N. buccalis mitanästhesiert wird, eignet sich hier die „hohe“ Leitungsanästhesie, auch Gow-Gates-Technik genannt, besonders. Die Kanüle wird dabei distal des zweiten Oberkiefermolaren inseriert und parallel der Linie Mundwinkel/Tragus in Richtung des äußeren Gehörgangs bis zum Knochenkontakt am Kondylenhals vorgeschoben. Die Schnittführung des Mukoperiostlappens inklusive einer gewünschten Blutfreiheit machte zudem eine vestibuläre Infiltrationsanästhesie erforderlich. Für beide Injektionen wurde 4%iges Articain mit einem Adrenalinzusatz von 1:100.000 (Ultracain D-S forte, Sanofi-Aventis Deutschland GmbH, Frankfurt) verwendet [3]. Postoperativ bekam die Patientin 600 mg Ibuprofen, die sie über 24 h alle 6 h einnehmen sollte.
Vorgehen bei der Unterkiefer-Augmentation
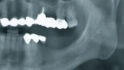
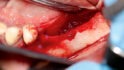
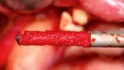
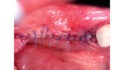
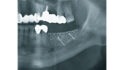
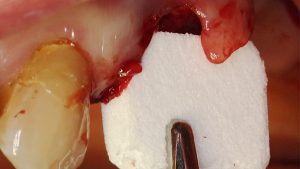
Mittels Raspatorium wurde entsprechend der Größe des Defekts zunächst der Mukoperiostlappen vom mandibulären Knochen abpräpariert und der Defekt freigelegt (Abb. 3). Es folgte die Entnahme des autologen Knochens aus dem Kieferwinkel mithilfe eines Bonescrapers (Abb. 4). Die gewonnenen Späne werden in der Regel mit einem synthetischen Knochenersatzmaterial angemischt, wobei ein Verhältnis von mindestens 10 % Eigenknochen angestrebt wird (Abb. 5), hier mit biphasischem Calciumphosphat (maxresorb, botiss biomaterials GmbH, Zossen). Zusätzlich wurde das Gemisch mit vorab hergestelltem i-PRF versehen, das die biologische Aktivität des Materials verstärken soll [4]. Nach der Sterilisation konnte das vorab CAD/CAM-gefertigte Titanmesh mit dem Knochenmaterial beschickt werden. Um die Blutversorgung zu verbessern, ist es zudem ratsam, den Knochen mit dem Bohrer leicht zu perforieren. Nachdem weiteres Knochenmaterial direkt auf den Defekt aufgebracht wurde, erfolgte das Anbringen des befüllten Meshs mit Osteosyntheseschrauben auf dem verbliebenen Knochen (Abb. 6). Auf die Anwendung einer resorbierbaren Kollagenmembran wurde verzichtet, jedoch wurden PRF-Membranen auf das Mesh appliziert, um die Weichgewebsheilung zu fördern sowie die Schwellung und die postoperativen Schmerzen zu minimieren [5]. Es ist anschließend wichtig, die Wunde speicheldicht zu verschließen. Mit einer leichten periostalen Inzision lässt sich der Mukoperiostlappen lingual und vestibulär zusätzlich mobilisieren. Mit monofilem, nicht resorbierbarem Faden konnte die Wunde so mit Matratzen- sowie Einzelnähten fest, aber spannungsfrei vernäht werden (Abb. 7). Postoperativ zeigte sich im OPG die passgenaue Abdeckung des Defekts (Abb. 8).
Implantation
Je nach Geometrie des Defekts kann nach vier bis sechs Monaten implantiert werden. Die Patientin erschien vier Monate später in der Klinik. Das Schmerzmanagement inklusive Single-Shot-Antibiose erfolgte analog der ersten Operation.
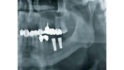
Aktuelle Studiendaten zeigen, dass intraprozedurale sowie postinterventionelle Schmerzen, vor allem auch bei Implantationen, durch die präemptive Analgesie – auch bei zusätzlicher postoperativer Gabe – geringer ausfallen [6, 7]. Unter erneuter Leitungsanästhesie mit Articain 1:100.000 wurde das Mesh entfernt. Die Knochensubstanz hatte sich vollständig ausgebildet, sodass die Tissue Level Implantate (Standard Plus, Straumann GmbH), 12 x 4,1 mm und 10 x 4,1 mm, wie geplant inseriert werden konnten (Abb. 9).
Diskussion – wann 1:100.000?
Da es sich bei Augmentationen zum einen um längere, auch postoperativ schmerzhafte Eingriffe handelt und zum anderen eine ausgeprägte Blutleere im Operationsgebiet gewünscht ist, empfiehlt sich hier der Einsatz von Articain mit dem Adrenalinzusatz 1:100.000. Weitere Indikationen für die Konzentration finden sich in Tabelle 1. Das Adrenalin sorgt für eine stärkere Vasokonstriktion und somit für eine bessere Übersicht, ein längeres Verbleiben im OP-Gebiet sowie eine längere therapeutische Nutzzeit und Anästhesietiefe [8]. In diesem Fall ist eine langanhaltende Schmerzausschaltung wünschenswert, bei anderen Eingriffen sollten sich Behandler jedoch die Frage stellen, ob eine Anästhesie von bis zu 3,8 Stunden bei der Leitungsanästhesie [9] und damit eine längere Beeinträchtigung des Patienten wirklich notwendig ist. Daher sollte die Konzentration 1:100.000 langen Eingriffen unter Infiltrationsanästhesie vorbehalten sein – aufgrund der dickeren Kortikalis vor allem im posterioren Unterkiefer. Außerdem steigt das Risiko von Komplikationen bei der Verwendung eines Adrenalinzusatzes.
Bei ungefähr 20 % aller intraoralen Injektionen ist zumindest kurzzeitig mit erhöhten körpereigenen Adrenalinspiegeln zu rechnen [10], die klinisch durchaus relevant sein können. Zusammen mit dem bereits vorhandenen Adrenalinzusatz im Lokalanästhetikum, das je nach Applikationsart auch in den systemischen Kreislauf eingeschwemmt wird, können unerwünschte Effekte auftreten [11].
Fazit zur Unterkiefer-Augmentation
Die oberste Maxime bei der Lokalanästhesie lautet: absolute Kontraindikationen ausschließen, weitere Vorerkrankungen (relative Kontraindikationen inkl. Reduktion auf 1:200.000) beachten, die Grenzdosis nach Körpergewicht einhalten und intravasale Injektionen durch Aspiration vermeiden [12]. Bei der Dosierung von Anästhetikum und Vasokonstriktor gilt: immer individuell einstellen und so viel wie nötig, aber so wenig wie möglich verabreichen. Der höchste Zusatz 1:100.000 sollte auch bei gesunden Patienten nur bei langen und potenziell sehr schmerzhaften Eingriffen eingesetzt werden.
| 1:100.000 ist indiziert bei längeren, schmerzhaften chirurgischen Eingriffen von ca. 75 Minuten |
|---|
| Osteotomien |
| Wurzelspitzenresektionen (Seitenzahnbereich) |
| Vestibulumplastik |
| Tiefe Inzisionen (z.B. Abszess, Zystektomie) |
| Sinuslift/Augmentationen |
| Multiple Implantationen >2 |
| Multiple Präparationen >3 |
Auswahl an Indikationen, bei denen ein Anästhetikum mit dem Adrenalinzusatz 1:100.000 empfehlenswert ist. In Teil II unserer Serie im Oktober zeigt ein weiteres Fallbeispiel, wann es sinnvoll ist, den Adrenalinzusatz zu reduzieren.
Diese Kasuistik wurde mit freundlicher Unterstützung von Sanofi nach einem realen Patientenfall aus der klinischen Praxis angefertigt. Bei ähnlich gelagerten Fällen ist die individuelle Therapieentscheidung durch die behandelnde Ärztin/den behandelnden Arzt maßgeblich. Die aktuellen Fachinformationen und Leitlinien sind zu beachten.
Der Experte

Foto: Uni Mainz
Univ.-Prof. Dr. Dr. Peer W. Kämmerer, M.A., FEBOMFS
Leitender Oberarzt/Stellvertretender Direktor der Klinik und Poliklinik für Mund-, Kiefer- und Gesichtschirurgie an der Universitätsmedizin der Johannes Gutenberg-Universität Mainz
peer.kaemmerer@unimedizin-mainz.de