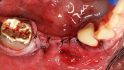
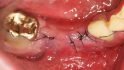
So lassen sich Implantate retten
Die Strategien für eine langfristige Rehabilitation des Alveolarkamms werden immer besser. Neue Ansätze reduzieren die Risiken und die Therapiebelastung. Dennoch kann sich zum Beispiel eine Periimplantitis entwickeln und das Implantat gefährden. Wie lässt sich ein Implantat heute so lange wie möglich erhalten? Wann kommt man an einer Explantation nicht vorbei?
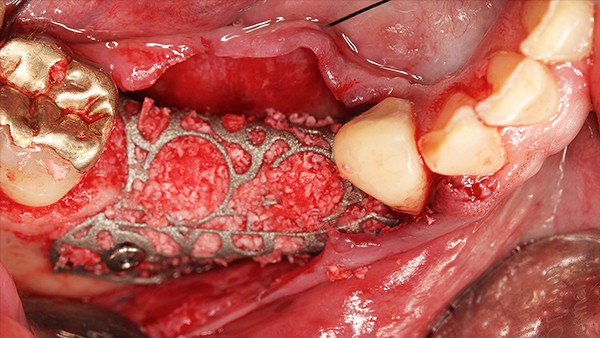
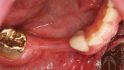
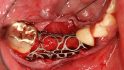
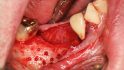
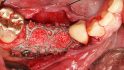
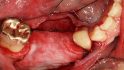
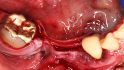
Hilfe bei Knochenverlust: Eine patientenindividuelle Titangitterstruktur, die mit autologen Knochenspänen und BioOss befüllt und am Ort des Defekts eingebracht wird. © Dr. Marcus Seiler MSc MSc
Herr Dr. Schlee, warum scheitern Implantate? Was sind die Hauptgründe?
Schlee: Wenn ich ehrlich bin, scheitern Implantate oft an uns Zahnärzten. Fehlpositionierungen, inadäquates Weichgewebsmanagement und Zementreste dürften eine häufige Ursachen sein. Deutlich seltener sind Misserfolge auf Materialmängel zurückzuführen. Selbstverständlich tragen auch die genetische Disposition des Patienten sowie fehlende Compliance zu möglichen Komplikationen bei. Kommen all diese Faktoren zusammen, ist der Misserfolg der Implantate natürlich vorprogrammiert.
Sprich, es entsteht Periimplantitis?
Al-Nawas: Richtig – und damit es so weit nicht kommt, sollte die Periimplantitisprophylaxe bereits bei der Insertion der Implantate beginnen. Denn das korrekt positionierte Implantat toleriert viel, das gut mit Knochen umbaute Implantat ebenfalls. Nicht selten scheitern Implantate völlig unnötig.
Warum?
Al-Nawas: Vor allem wegen mangelhafter Planung. Das dürfte einer der Hauptgründe für Komplikationen und aufwendiges Nachbessern sein. Es ist einfach bitter, wenn man im Nachhinein ein langwieriges, invasives Weichgewebsmanagement betreiben muss, obwohl man mit einfachen Maßnahmen – nämlich einem kleinen Rolllappen – bei der OP-Freilegung tolles Weichgewebe hätte schaffen können.
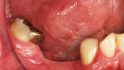
Schlee: Und noch bitterer sind schlecht positionierte Implantate. Da lässt sich allenfalls mit CAD/CAM-designten Abutments noch etwas richten, aber nur bis zu einem bestimmten Limit. Kann der Patient damit leben und entwickelt sich keine Periimplantitis, kann das Implantat in situ bleiben. Ist das Implantat aber kontaminiert und ästhetisch schwer zu tolerieren, plädiere ich in solchen Fällen nicht fürs Retten …
Weil es zu teuer wäre?
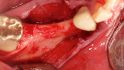
Schlee: Chirurgische Maßnahmen können das ursächliche Problem – die Fehlpositionierung – nicht lösen und sind deshalb misserfolgsbehaftet und deshalb manchmal wirtschaftlich nicht sinnvoll. Die Implantatreinigung, zum Beispiel das elektrolytische Verfahren, und vor allem die anschließende Augmentation, schlagen mit 1000 bis maximal 2000 Euro zu Buche.
Al-Nawas: Das „Retten“ muss genau durchdacht werden. Lässt sich ein ästhetisches und funktionelles Outcome realisieren? Welche Augmentationen sind dafür erforderlich? Braucht es ein Weichgewebstransplantat, um die Fehlposition zu kaschieren?
Schlee: Auch ich überlege mir sehr genau, ob ich meinem Patienten das zumute oder nicht. Bei einer Arbeit auf sechs Implantaten, bei denen ein strategisch wichtiger Pfeiler verloren geht, rechnet sich das mit Sicherheit – egal wie hoch der Aufwand ist. Bei einer Einzelzahnsituation kann es allerdings durchaus sinnvoller sein, zu explantieren. Vor allem dann, wenn man die Keramikkrone für die elektrolytische Reinigung zerstören und augmentieren muss.
- Es gibt Hinweise, dass zu dünnes periimplantäres Weichgewebe zu erhöhtem Knochenabbau führt. Wo exakt die Grenze liegt, ist allerdings unklar.
- Als optimale Weichgewebsdicke ums Implantat gelten 2 bis 3 mm. Entsprechende Studien fehlen allerdings noch. Die Evidenz ist gering.
- Es gibt derzeit nur eine Hundestudie mit fünf Hunden (Berglund et al.)
- Doch derzeit laufen Studien an. PD Dr. Markus Schlee veröffentlicht Siebenjahresergebnisse und rechnet in den kommenden zwei Jahren mit mehr Evidenz dazu.
- Für noch wichtiger als die Weichgewebsdicke hält Schlee ausreichend befestigte Mukosa. Das sind allerdings Erfahrungswerte.
- Eine neue Leitlinie „Periimplantäre Weichgewebsaugmentation“ wird voraussichtlich Ende 2020 fertiggestellt. Die Leitlinienverantwortung liegt bei Schlee, die Koordination hat Prof. Dr. Dr. Dr. Robert Sader inne.
Quelle: Schlee
Herr Professor Al-Nawas, was genau meinen Sie mit „kaschieren“?
Al-Nawas: Das Weichgewebsmanagement ist häufig nichts anderes als ein „Feigenblatt“ für falsch gesetzte Implantate. Mit kräftigem Weichgewebe lässt sich eine Situation retten, die im Grunde nicht besonders stabil ist.
Und zudem nur von Spezialisten zu behandeln ist?
Schlee: Es braucht auf jeden Fall Erfahrung im Umgang mit Augmentationstechniken und -materialien. Der Behandler muss in der Lage sein, Lappen zu mobilisieren und einen sicheren Wundverschluss durchzuführen. All dies entscheidet über den Erfolg der Implantatrettung nach einer Periimplantitistherapie.
Noch sinnvoller wäre eine wirksame Periimplantitisprophylaxe. Spielt die Implantatsondierung tatsächlich eine Schlüsselrolle bei der Diagnostik der periimplantären Erkrankung?
Schlee: Ja, vorausgesetzt das Ergebnis wird auch korrekt interpretiert.
Sprich: Ein komplett gesundes periimplantäres Gewebe kann leicht bluten?
Schlee: Korrekt, denn das Weichgewebe ist nur sehr schwach über das Saumepithel hemidesmodontal am Implantat befestigt. Darunter liegt das Bindegewebe am Abutment oder Implantat an. Jedes Implantat blutet auf Sondierung, wenn das Saumepithel penetriert wird. Das geschieht schon bei geringem Druck und ist schwer kontrollierbar. Den kleinen Blutpunkt nach Sondieren würde ich nicht als positives BoP (Bleeding on Probing) interpretieren. Nur wenn da Blut herausschießt, ist das für mich ein positiver Befund, besonders, wenn es mit Pus kombiniert ist. Der BoP-Index muss für die Periimplantitisdiagnose anders bewertet werden. Ein „Blutpunkt“ bei der Implantatsondierung ist nämlich normal. Schießt aber das Blut heraus, ist das ein sicheres Symptom für eine Periimplantitis. Eine genauere Differenzierung dieses diagnostischen Verfahrens zur Beurteilungen von Entzündungen am Implantat muss meines Erachtens unbedingt in die Periimplantitis-Klassifikation integriert werden.
Lässt sich eine Infektionsgefahr mit einem prophylaktischen subgingivalen Air-Polishing bannen?
Schlee: Druckluft in den Sulkus zu führen, halte ich für gefährlich. Es kann zu einer Emphysem-Bildung kommen; das ist mir selbst schon passiert. Eine Patientin klagte nach Druckluftreinigung am 47er über Schmerzen bis ins Mediastinum. Ich habe sie sicherheitshalber in die Klinik einweisen lassen. Ob das nötig war, sei dahingestellt, aber ich hielt es für opportun. Zudem stellt sich die Frage nach der Sterilität. Schließlich arbeiten wir in einem infizierten Gebiet und weder das Pulver noch das Wasser ist steril.
Wäre denn eine prophylaktische elektrolytische Reinigung der Implantate sinnvoll? Funktioniert das überhaupt, ohne die prothetische Versorgung abzunehmen?
Schlee: Da nehmen Sie den nächsten Schritt vorweg. Wir wollen ein Tool entwickeln, mithilfe dessen man Implantate mit keinem oder geringem Knochenabbau auch ohne Aufklappen behandeln kann. Das wäre dann ein ideales Tool für die Prophylaxe.
Herr Dr. Braun, sind Misserfolge in der Implantologie vor allem auf Anwenderfehler und mangelnde Patientencompliance zurückzuführen? Was sagen Sie aus der Herstellerperspektive?
Braun: So hart möchte ich nicht urteilen. Die Implantologie der vergangenen 20 oder 30 Jahre ist eine Erfolgsgeschichte. In diesem Zeitraum gab es enorme Fortschritte, nicht nur bei den Implantaten und Augmentationsmaterialien. Weiterentwickelt haben sich auch die Behandlungsprotokolle, was beispielsweise bei der Sofortimplantation deutlich wird.
Ist die Periimplantitis Ihrer Ansicht nach einer der Hauptgründe für das Scheitern von Implantaten?
Braun: Das kommt auf die Periimplantitisdefinition an.
Schlee: Und über eine korrekte Periimplantitisdefinition wird kontrovers diskutiert. Mir missfällt, dass der Faktor Ätiologie in den gebräuchlichen Definitionen keine Rolle spielt. Ein zementrestinduzierter Knochenabbau mit anschließender Infektion der freilegenden Implantatoberfläche sieht klinisch genau so aus, wie eine Periimplantitis, die durch eine Disbalance zwischen bakterieller Belastung und unangemessener Wirtsantwort entstanden ist. Beides nennt man Periimplantitis, obgleich es sich um völlig verschiedene Entitäten handelt. Auch deshalb differieren Angaben zur Prävalenz zwischen 5 Prozent und 20 Prozent.
Wie kann das sein?
Schlee: Gute Frage. Es dauert, bis man bereit ist, traditionelle Denkmuster zu verlassen. Beispielsweise korreliert ein gewisses Remodeling mit dem verwendeten Implantattyp. Zudem wird das auch durch den Chirurgen und die Prothetik beeinflusst. Ab wie viel Knochenabbau man das dann als pathologisch definieren soll, ist eine gute Frage.
Braun: Deshalb gilt es den Periimplantitisauslöser klar zu identifizieren. War aber nie ausreichend Knochen vorhanden und die Implantatposition ungünstig, bleibt möglicherweise nur die Explantation.
Kann man denn anschließend mehr oder weniger reibungslos erneut Implantate inserieren?
Al-Nawas: Reibungslos mit Sicherheit nicht. Nach dem Explantieren kommt es häufig zu einem vertikalen Knochenverlust. Das heißt, häufig müssen wir zweizeitig vorgehen: erst Knochen aufbauen und dann Implantate inserieren. Mit individualisierten Titangittern ist das heute aber zu bewältigen.
Würden Umbrella- bzw. Schirmschrauben nicht reichen?
Al-Nawas: Nur bei kleineren Defekten, bei größeren bevorzuge ich individuelle Titangitter zum Stabilisieren. Das ist aus meiner Sicht leichter. Die Technik ist aber gar nicht so entscheidend. Es geht darum, sauber Platz zu schaffen, nur dann kann man gewinnen.
Herr Dr. Schlee, welche Technik bevorzugen Sie?
Schlee: Man muss sich einfach einmal die biologischen Prinzipien der Wundheilung vor Augen führen: Es braucht Raum, Ruhe und eine schnelle Durchbauung mit Blutgefäßen, sodass der verwendete Knochen oder das Knochenersatzmaterial ein- und umgebaut werden kann. Mit dem Knochenblock gelingt das nicht. Allerdings hält der Block mit seiner bloßen Existenz offen, beim partikulären Material braucht es Hilfsmittel, Membranen, Titangitter oder Schirmschrauben. Dafür baut sich partikuläres Material schneller um. Deshalb bevorzuge ich Umbrellaschrauben in Kombination mit partikulärem Knochen oder Knochenersatzmaterial.
Im Video erklärt Prof. Dr. Dr. Bilal Al-Nawas sein Protokoll.
Herr Professor Al-Nawas, sind die Blöcke „out“?
Al-Nawas: Knochenblöcke sind heute nicht mehr so sexy. Ganz verkehrt waren sie natürlich auch nicht. Die Blöcke zeigen eine sehr langsame Resorption und sind viel stabiler als die partikulären Materialien, die ja stets mit „irgendwas Resorptionsstabilem“ gemischt werden müssen. Grundsätzlich ist das Manko aller vertikalen Techniken: Niemand kann einschätzen, wann sie durchbaut sind.
Gilt das auch für allogene Blöcke? Immerhin lassen sie sich individuell fräsen, eine invasive Entnahme entfällt.
Al-Nawas: Das gilt auch für allogene Blöcke. Sie sind zwar individuell anzupassen, haben aber natürlich zwei Probleme: Das Material ist sehr heterogen, denn jeder Mensch ist anders, ernährt sich anders, nimmt Medikamente oder nicht etc. Kurz: Der eine resorbiert schneller, der andere langsamer, und dieses Resorptionsverhalten ist kaum vorherzusagen. Zudem handelt es sich bei den CAD/CAM-Blöcken meist um spongiöses Material, das mit einem Knochenersatzmaterial zu umhüllen ist.
Braun: Und allogenes Material ist nicht sauber. Untersuchungen von Allografts an den Universitäten Freiburg und Frankfurt haben gezeigt, dass in diesen Materialien verschiedenste Zellbestandteile enthalten sind, sodass kaum von einer definierten Zusammensetzung ausgegangen werden kann. Jeder Hersteller hat sein eigenes Verfahren; eine standardisierte Herstellung gibt es nicht. Das heißt nicht automatisch, dass da eine Gefahr lauert, aber die Voraussetzungen sind gegeben, zumindest für eine immunologische Reaktion. Denn kollagenhaltige allogene Blöcke enthalten auch Zellbestandteile. Entfernt man das Kollagen, erhält man zwar einen reinen, aber hochporösen Block, der sich kaum schrauben lässt. Er würde dabei in kleine Blöckchen zerbröseln.
Schlee: Weltweit ist allerdings keine Infektionsübertragung bekannt. Allerdings bin ich davon überzeugt, dass allogene KEM eine milde Immunreaktion auslösen; ob diese klinisch relevant ist oder nicht – darüber kann man sich trefflich streiten.
Wann kommen superspongiöse allogene Blöcke überhaupt zum Einsatz?
Braun: Sie lassen sich zum Beispiel bei Interpositionsplastiken einsetzen, also dann, wenn ein Block in einen Defekt eingelagert werden kann. Einzelne Anwender nutzen sie auch in der Kieferhöhle. Bei regenerativen Maßnahmen nach Periimplantitistherapie sehe ich keine Vorteile in der Anwendung solcher Blöcke. Das Risiko des Totalverlusts – egal ob autolog, allogen oder xenogen – ist beim Block deutlich höher.
Dennoch hat man das Gefühl, allogene Blöcke werden immer beliebter. Was ist der Grund? Keine Entnahmemorbidität?
Al-Nawas: Die CAD/CAM-Blöcke sind vor allem deshalb beliebt, weil sie die 3D-Planung individuell ermöglichen. Doch sie sind extrem teuer. Zudem verwendet man humanes Fremdmaterial mit allem, was ethisch und biologisch dahinter steht. Warum soll man sich das antun? Wir haben doch Alternativen. Ich bin mir nicht sicher, ob die Zukunft der Knochenersatzmaterialien tatsächlich im allogenen Material liegt.
Wo dann?
Al-Nawas: In innovativen neuen Biomaterialien.
Braun: Wir halten die allogenen Materialien definitiv nicht für zukunftsweisend. Mit dem Inkrafttreten der neuen Medical Device Regulation (MDR) im kommenden Jahr werden die Anforderungen an die Herstellung und Dokumentation von Medizinprodukten deutlich zunehmen. Die Anforderungen für die als Arzneimittel zugelassenen Allografts werden sicherlich auch eher verschärft als gelockert. Dann dürften alle Hersteller von Knochenersatzmaterialien dazu verpflichtet sein, genaue Angaben über die Bestandteile ihrer Produkte zu machen.
In den sonst so streng reglementierenden US-Zulassungsbehörden scheint das niemanden zu tangieren. Allografts boomen dort seit Jahren. Warum?
Braun: Das frage ich mich auch. Eine Erklärung, die ich auf diese Frage bekommen habe, war, dass der patriotische Stellenwert von Gewebespenden in den USA auf den Vietnamkrieg zurückzuführen ist. Ob das tatsächlich zutrifft, kann ich nicht beurteilen. Gewebespenden hatten in den USA damals eine enorme Bedeutung bei der Behandlung verletzter Soldaten. Das Argument, es gebe ja keine Infektionsübertagung, ist übrigens so nicht richtig: Es existieren sehr wohl Meldungen über Infektionsübertragungen, allerdings bei Materialien, die in Deutschland aufgrund ihres Reinigungsverfahrens nicht zugelassen sind. Da es aber kein Implantatregister für Allografts gibt, lassen sich später auftretende Komplikation auch nicht zurückverfolgen.
Intraossäre Defekte
Risikopotenzial Klasse 1
- Schüsselförmige Defekte mit allen Knochenwänden: In 100 Prozent der Fälle komplette Osseointegration nach elektrolytischer Reinigung der Implantate.
Risikopotenzial Klasse 2
- Schüsselförmige Defekte, fehlende Wände. In der Hälfte der Fälle komplette Osseointegration.
Extraossäre Defekte
Risikopotenzial Klasse RP 3
- Vertikale Defekte, in 20 Prozent der Fälle komplette Reosseointegration
- Daten über 200 bis 300 Fälle folgen in einem Jahr.
Dr. Dr. Markus Schlee, Forchheim, Studie zur elektrolytischen Implantatreingung, 50 Fälle. Klassifikation angelehnt an die Periimplantitisklassifikation von Prof. Dr. Frank Schwarz.
Wer partikuläres KEM bevorzugt, muss Volumen stabilisieren. Titanverstärkte Membranen, individuelle Titangitter oder Schirmschrauben, welche Methode favorisieren Sie?
Schlee: Am kostengünstigsten, einfachsten und schnellsten funktioniert die Volumenstabilität mit Schirmschrauben.
Die auch Geistlich inzwischen anbietet …
Braun: … und zwar in den Durchmessern 4 und 6 mm. Noch sind wir in der Testphase, aber die ersten Ergebnisse sind sehr überzeugend. Wir empfehlen bei kleineren Defekten die Schirmschraube, bei größeren das ReOSS-Gitter, das „ready to use“ geliefert wird. Das ist bei größeren Defekten einfacher und schneller.
Sind die Gitter nicht erheblich teurer?
Braun: Nein, eine Schraube kostet 40 bis 50 Euro, verwendet man fünf bis sechs, sind wir schon bei dem Preis für ein ReOSS-Gitter.
Schlee: … das man aber auch noch anschrauben muss.
Welche Augmentationsmethode empfehlen Sie besonders auch Einsteigern?
Al-Nawas: Knochenaugmentation per se ist ein sehr komplexer Eingriff. Anfänger sollten mit Guided-Bone-Regeneration starten, Erfahrungen mit Membranen und plastischer Deckung sammeln und sich erst dann an kleinere dreiwandige Defekte mit vertikaler Komponente – zum Beispiel mit einer Umbrellaschraube oder mit einem Titangitter – wagen.
Schlee: Das „Schlachtentscheidende“ beim Augmentieren ist allerdings weniger die Wahl des Augmentats, sondern vielmehr der Umgang mit dem Weichgewebe. Wie lässt sich das Weichgewebe bzw. der Lappen passend und spannungsfrei über dem Augmentat mobilisieren? Das ist die Kunst. Der gewählte „Brösel“ hat keinen Einfluss auf den Erfolg, da gibt es vergleichende Studien. Man muss sich einfach mit dem Material anfreunden, seine Routine entwickeln, und dann kann man mit beiden Materialien gute Ergebnisse erzielen.
Was kann denn beim Weichgewebsmanagement schiefgehen?
Schlee: Hält die Naht nicht, drohen Wunddehiszenzen, und das Augmentat geht wieder verloren. Dann ist es völlig egal, welcher Partikel darunter lag.
Muss es denn ein autologes Bindegewebstransplantat sein?
Braun: Es gibt Alternativen aus dem Blister, aber viele Kollegen sind beim Weichgewebe noch sehr stark autolog unterwegs. Sie nehmen entweder ein Bindegewebstransplantat oder ein freies Schleimhauttransplantat.
Die zu entnehmen, ist für den Patienten hoch invasiv …
Braun: Ja, vor allem das freie Schleimhauttransplantat. Unser Ansatz ist es natürlich, diese autologen Transplantate zu ersetzen. Für das freie Schleimhautransplantat und das Bindegewebstransplantat bieten wir bereits spannende Lösungen aus dem Blister: Geistlich Fibro-Gide als Ersatz für das Bindegewebstransplantat dient der Verdickung, Geistlich Mucograft wird für die Verbreiterung der keratinisierten Gingiva in der offenen Einheilung eingesetzt.
Kritisiert wird ja häufig, dass mit den Bindegewebsersatzmaterialien die minimalinvasive Tunneltechnik nicht funktioniere …
Braun: Wer auf Ersatzmaterialien wechselt, muss auch sein Protokoll ändern. Protokolle, die hervorragend bei autologen Transplantaten funktioniert haben, können nicht einfach 1:1 übernommen werden. Es handelt sich um eigenständige Produkte, die auch ein individuelles Protokoll benötigen. Wir verwenden für die Entwicklung solcher Protokolle fast ebenso viel Zeit wie für die Entwicklung des Produkts. Generell bieten diese Ersatzmaterialien neue Möglichkeiten, haben aber auch ihre eigenen Limitierungen.
Kommen wir zu Eigenblutprotokollen: Welche Rolle spielt PRF bei der Defektbehandlung?
Al-Nawas: Die Wundheilung wird durch biologisiertes Material, ob Blut oder PRF (platelet-rich fibrin), gefördert. In dem Punkt sind sich die Experten einig. Ohne Blut/PRF-Biologie geht es schlechter, da herrscht Konsens. Der Effekt, ein konzentriertes Thrombozytenkonzentrat in das KEM zu mischen, ist verglichen mit der Beigabe von Blut allerdings sehr gering. Die Daten zur Ridge Preservation zeigen aber: Gibt man PRF in die Alveole, ist der Volumenerhalt höher. Schöne Daten dazu gibt es auch im Bereich der Weisheitszahnosteotomie. Das heißt, die Wundheilung wird wohl beschleunigt.
Schlee: Ich verwende diverse Eigenblutprotokolle bereits seit 20 Jahren. In-vitro-Daten versprechen Vorteile, klinisch haben wir allerdings sehr wenig Evidenz, was ich bedaure.
Wieso fehlt es da an Evidenz? Prof. Dr. Shahram Ghanaati forscht in Frankfurt doch schon seit Jahren …
Schlee: In Frankfurt wird ganz wichtige Grundlagenforschung zu dem Thema betrieben. Was wir als wissenschaftliche Community noch schaffen müssen, ist zu beweisen, dass die Applikation von PRF klinisch im Ergebnis Unterschiede macht. Dazu sind groß angelegte randomisierte und kontrollierte Studien mit sehr hohen Fallzahlen nötig, und die Kosten dafür verhindern wohl diese Forschung. Derzeit haben wir schwache Evidenz, dass PRF Vorteile bei GTR bringt.
Sie meinen, ob die PRF-Gabe die Frühverlustrate der Implantate senkt?
Schlee: Korrekt, sie liegt derzeit bei 0,5 bis einem Prozent. Eine solche Studie wäre aber sehr teuer, denn es müssten wohl große Zahlen von Implantaten untersucht werden, um signifikante Unterschiede herauszufiltern. Wenn die Fachgesellschaften, die DGI und DGPARO, ihre Mitglieder aufrufen würden, dies multizentrisch zu untersuchen, wären wir einen Schritt weiter.
Das klingt spannend. Herr Dr. Braun, wie befasst sich Geistlich mit dem Thema?
Braun: Inhaltlich, wir rücken das Thema Biologisierung in den Fokus. Für das Weichgewebe ist die Biologisierung nachweislich vorteilhaft, für den Knochen gibt es wenig brauchbare Evidenz. „Evidenzgrad 5“ würde ich schätzen. Aber: Ich kann mir durchaus vorstellen, dass PRF-Einsatz dort einen Sekundäreffekt hat: Das Material stabilisiert, und ein Augmentat braucht Stabilität. Aber PRF fördert die primäre Wundheilung, das ist belegt. Interessant für die Weichgewebsregeneration aus unserer Sicht wäre: Geistlich liefert die Matrix, ohne Zellen, sauber, und mit PRF wird die primäre Wundheilung beschleunigt.
Analog zur Biologisierung von BioOss mit autologem Knochen …
Braun: … würde die Matrix mit PRF biologisiert. Das würde die Matrix stabilisieren. Sie wäre weniger fragil und ließe sich zum Beispiel leichter durch den Tunnel ziehen. Auch die Wundheilung wird durch die Biologisierung angekurbelt.
Könnten patientenindividuelle Faktoren wie bestimmte Erkrankungen oder die Einnahme von Medikamenten eine Wirkung des PRF auch einschränken? Gibt es da Daten?
Braun: Die Datenlage scheint mir diesbezüglich noch sehr dünn. Viele Parameter kennen wir noch nicht, und das macht eine generelle Aussage für jeden Patienten so schwierig.
In welchen weiteren Bereichen sehen Sie noch Forschungsbedarf?
Al-Nawas: Schön wäre ein resorbierbares Meshmaterial.
Zum Beispiel Magnesium?
Schlee: Das Problem bei Magnesium ist, dass bei dem Abbau von Magnesium Gas entsteht, das wieder resorbiert werden muss. Schließlich vollen wir nicht, dass das Gewebe um das Augmentat buchstäblich aufplatzt. Ich verwende derzeit Umbrellaschrauben aus chirurgischem Stahl statt Titanschrauben, um eine Osseointegration zu verhindern.
Was ist die Alternative?
Schlee: Ich nehme jetzt Schrauben aus chirurgischem Stahl statt Titanschrauben, um eine Osseointegration zu verhindern.
Al-Nawas: Interessant könnten resorbierbare Polymere sein. Hersteller sollten auf diesem Gebiet weiter forschen. Denn die Meshes zu entfernen ist nicht immer einfach.
Warum setzt man nicht auf Stahlmeshes?
Al-Nawas: Das ist old-fashioned. Außerdem kann man Stahl nicht drucken. Ich setze auf innovative Biomaterialien und bin gespannt, was sich da tut.
+ Die Hauptursachen für das Scheitern von Implantaten sind Fehlpositionierungen, inadäquates Weichgewebsmanagement und Zementreste. Korrekt positionierte Implantate tolerieren viel, gut mit Knochen umbaute Implantate ebenfalls. Nicht selten scheitern Implantate völlig unnötig.
+ Ein „Retten“ von Implantaten muss genau durchdacht werden. Lässt sich ein ästhetisches und funktionelles Outcome realisieren? Welche Augmentationen sind dafür erforderlich? Was kann dem Patienten zugemutet werden?
+ Es gilt, den Auslöser des Scheiterns klar zu definieren. War nie ausreichend Knochen vorhanden und die Implantatposition ungünstig, bleibt möglicherweise nur die Explantation.
+ Nach dem Explantieren kommt es häufig zu einem vertikalen Knochenverlust. Das heißt, ein zweizeitiges Vorgehen ist häufig indiziert: erst Knochen aufbauen und dann inserieren.
+ Partikuläres KEM ist dabei vorzuziehen. Das Risiko des Totalverlusts – egal ob autolog, allogen oder xenogen – ist beim Block deutlich höher.
+ Partikuläres KEM baut sich schneller um, braucht aber Hilfsmittel: Membranen, Titangitter oder Schirmschrauben.
+ Um den Patienten nach der Augmentation einen Zweiteingriff zu ersparen, wären auch für den Knochenaufbau Scaffolds aus resorbierbaren Biomaterialien wünschenswert.
+ Immer wichtiger wird das Thema Biologisierung. In welchem Maße durch Blut oder PRF biologisiertes Material Vorteile auch bei der GTR bringt, ist derzeit unklar.
+ A und O beim Retten von Implantaten ist eine wirksame Periimplantitisprophylaxe. Dabei spielt die Implantatsondierung eine entscheidende Rolle, vorausgesetzt, sie wird richtig interpretiert.
Die Experten

Prof. Dr. Dr. Bilal Al-Nawas
Direktor der Klinik für Mund-, Kiefer- und Gesichtschirurgie, plastische Operationen der Universität Mainz
Al-Nawas@uni-mainz.de

PD Dr. Dr. Markus Schlee
niedergelassen in eigener Praxis in Forchheim
markus.schlee@32schoenezaehne.de

Dr. Thomas Braun
seit 2001 Geschäftsführer der Geistlich Biomaterials GmbH
Thomas.Braun@geistlich.de