Fibrinmatrix: Eigenblutpräparate im Praxisalltag
Die Bedeutung der Blutkonzentrate im Praxisalltag steigt. Wachstumsfaktoren sind en vogue. Wie lassen sich entsprechende Behandlungsprotokolle am einfachsten in den Praxisalltag integrieren? Dr. Sebastian Becher, Düsseldorf, liefert eine Standortbestimmung.
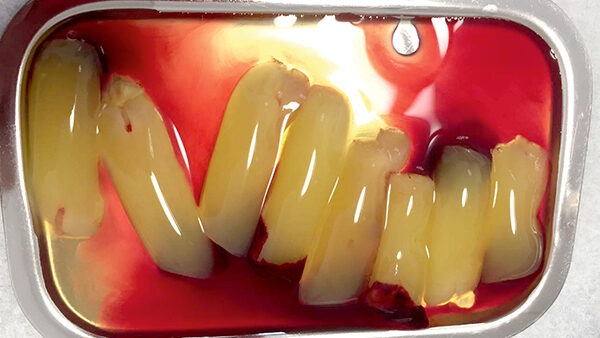
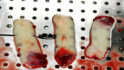
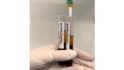
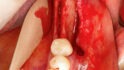
Abb. 1a Clots nach direkter Entnahme aus dem Röhrchen © Becher
Immer mehr Praxen setzen Eigenblutkonzentrate zur Förderung der Wundheilung ein. Steigen solche Behandlungsprotokolle zum Standard auf?
Becher: Das könnte sich für eine Fibrinmatrix durchaus so entwickeln. Wir arbeiten seit 2015 mit PRF-Systemen und setzen L-PRF nahezu täglich in unterschiedlichen Indikationen ein.
Sie sprechen von PRF-Systemen? Was genau heißt das?
Becher: PRF ist die Abkürzung für Platelet Rich Fibrin, also eine thrombozytenhaltige Fibrinmatrix. L-PRF steht dabei für leukozytenhaltiges PRF – für eine Leukozyten- und Thrombozytenhaltige Fibrinmatrix. Im Gegensatz zu Platelet Rich Plasma (PRP) oder Plasma Rich in Growth Factors (PRGF) lässt es sich ohne den Zusatz von Antikoagulantien allein aus dem venösen Patientenblut über die Zentrifugation gewinnen. Das Prinzip wurde 2001 erstmals von Dr. Joseph Choukroun, Nizza, als „Plättchenkonzentrate der zweiten Generation“ beschrieben. Die Fibrinmatrix polymerisiert dabei extrakorporal über natürliche Prozesse während der Zentrifugation. Der PRF-Clot beinhaltet nach Zentrifugation nahezu alle Thrombozyten, ca. 50% der Leukozyten und zahlreiche Wachstumsfaktoren wie z.B. PDGF, IL1-ß, VEGF und TGF-ß. Die wundheilungsfördernden Effekte beruhen dabei auf dem Zusammenspiel des PRF mit dem umliegenden Gewebe, wobei der Förderung der Angiogenese durch PRF eine zentrale Rolle zukommt. Je nach Zentrifugationszeit können dabei feste und flüssige Phasen hergestellt werden.
Das bedeutet?
Becher: Flüssiges Fibrinogen kann zur Förderung der Wundheilung in das Gewebe injiziert werden, zum Beispiel nach Zugangslappenoperationen, nach Weisheitszahnoperationen, aber auch nach implantologischen Eingriffen. Ebenso kann dies zur Biologisierung von Knochenersatzmaterialien (KEM) verwendet werden.
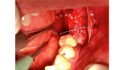
L-PRF als feste Phase dagegen kommt als Membran oder Plug zum Einsatz – zum Beispiel in Extraktionsalveolen, in Resektionshöhlen nach Wurzelspitzenresektion (WSR) oder auch in Zystenlumen nach Zystektomien.
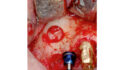
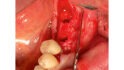
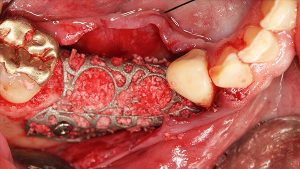
Von klinisch besonderem Interesse ist die Biologisierung von Knochenersatzmaterialien im Rahmen der Augmentationschirurgie. Dazu wird das PRF nach Partikulierung mit dem KEM vermischt und anschließend mit der flüssigen Phase benetzt – maximal im Verhältnis 50:50. Das Resultat ist ein mechanisch stabilisiertes und biologisiertes KEM. Je nach Protokoll wird dieser in der Literatur als sticky bone oder L-PRF-Block bezeichnet. Die Kombination aus mechanischer Stabilisierung des partikulären KEMs und der Biologisierung wird den Indikationsbereich von partikulärem KEM sicherlich erweitern können.
Inwiefern? Was schwebt Ihnen vor?
Becher: Die Limitation von partikulärem Knochenersatzmaterial ist sicherlich zu einem gewissen Teil durch deren mechanische Instabilität zu erklären. Studien zeigen, dass Stabilisierungsmaßnahmen des Augmentats zu weniger Migration des Augmentats generell und besserer Lagestabilität im crestalen Bereich führt. PRF kann partikuläres Material biologisieren und zudem mechanisch stabilisieren. Ob in Zukunft für gewisse Indikationen autologe Knochenblöcke durch ein entsprechendes Protokoll ersetzt werden können, müssen entsprechende Studien allerdings noch zeigen.
Zurück zum Behandlungsprotokoll und den unterschiedlichen Eigenblutpräparaten. Es lassen sich Membrane, Clots, Fibrinmatrices und Plugs herstellen. Wie funktioniert das?
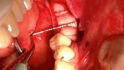
Becher: Wenn das Eigenblut zentrifugiert wird, entsteht ein Koagulat, das mit Pinzette dem Reagenzgläschen entnommen und anschließend weiterverarbeitet wird. Denn es enthält noch relativ viel Flüssigkeit. Dieses Exsudat wird quasi herausgepresst, um das Koagulat – sprich die Fibrinmatrix als Membran oder Plug – weiter zu konzentrieren.
Fibrinmatrix und Clot ist also das gleiche?
Becher: Nicht ganz. Der Clot, welcher das Resultat der Zentrifugation zur Herstellung der festen Phase ist, beinhaltet die Fibrinmatrix sowie Thrombozyten, Leukozyten und Wachstumsfaktoren. Die Fibrinmatrix ist sozusagen das Grundgerüst des Clots. Der Clot kann nach Entnahme aus dem Röhrchen (Vakuette) weiterverarbeitet werden.
Wie funktioniert das konkret?
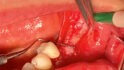
Becher: Die Fibrinmatrix ist hoch angereichert mit Thrombozyten, Leukozyten und Wachstumsfaktoren. In der sogenannten Xpressionbox (IntraSpin-System, Camlog) lässt sich die Membran herstellen, in dem Zylinder der Plug. Alveolen fülle ich übrigens am liebsten mit der PRF-Membran, da sich diese sehr gut in das Zahnfach applizieren lässt.
Die Membran nutzt man zum Beispiel auch im Rahmen der Augmentationschirurgie. Zum einen zur Biologisierung in Kombination mit der flüssigen Phase als auch zur Abdeckung des Augmentats zum Weichgewebe hin. Dadurch werden entsprechende wundheilungsfördernde Botenstoffe direkt unter dem bedeckenden Weichgewebe angereichert. Unserer Beobachtung nach führt dies zu deutlich geringeren Schwellungen und einem schnelleren dichten Wundverschluss. Wichtig: Die PRF-Membran hat keine Barrierefunktion wie etwa eine Kollagenmembran. Diese muss je nach Situation und entsprechenden Protokollen zusätzlich eingesetzt werden.
Und wann sind Plugs indiziert?
Becher: Damit fülle ich größere Zystenlumen auf. Denn Plugs bringen etwas mehr Volumen mit sich als PRF-Membranen. Die Entscheidung PRF-Plugs versus PRF-Membranen zur Auffüllung eines Zystenlumens oder einer Alveole kann der Behandler aber stets nach individuellen Vorlieben und mit Blick auf die Defektsituation treffen.
Bei welchen weiteren Indikationen setzen Sie Blutkonzentrate ein?
Becher: Wir setzen im klinischen Alltag PRF ein bei
- Weisheitszahnentfernungen,
- Wurzelspitzenresektionen,
- Zahnextraktionen – Socket/Ridge Preservation – Zystektomien,
- Augmentationen sowie als
- Füllmaterial im Rahmen des externen Sinuslifts ein.
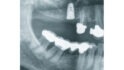
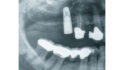
Zur Anwendung von PRF beim externen Sinuslift zeigen aktuelle Studien recht heterogene Daten, sodass gegenwärtig davon ausgegangen werden kann, dass die Beimengung von PRF zum Knochenersatzmaterial keinen relevanten klinischen Vorteil zu bringen scheint. Spannend wird es allerdings in der Anwendung von PRF als alleiniges Füllmaterial. Hier konnte gezeigt werden, dass bei einer geringen orovestibulären Ausdehnung und simultaner Implantation eine knöcherne Regeneration möglich ist. Der entscheidende Punkt scheint dabei die simultane Implantation zu sein, da über den Tentpole-Effekt ein Kollaps des geschaffenen Raums unterhalb der Schneider´schen Membran verhindert wird (Abb. 2). Auch eine Perforation der Schneider´schen Membran lässt sich mit einer PRF-Membran recht einfach verschließen.
Zudem beeinflusst PRF unabhängig vom Anwendungsbereich vor allem die frühe Phase der Wundheilung sehr positiv. So beobachten wir fast durchgehend eine sehr schnelle weichgewebliche Heilung, weniger Schwellung und weniger Schmerzen. Beim Re-entry nach Augmentation bei einem zweizeitigen Vorgehen sehen wir zudem ein sehr gut vaskularisiertes Augmentat.
Generell ergänzt PRF klinisch evidente Konzepte in der Regel sinnvoll. In manchen Bereichen kann es eine Alternative sein, zum Beispiel beim einzeitigen externen Sinuslift bei schmalem Sinus maxillaris.
- Blutkonzentrate wie leukozyten- und thrombozytenreiche Fibrinmatrizes fördern auf eine einfache und unkomplizierte Art die natürliche Wundheilung und Regeneration von Hart- und Weichgewebe – ohne Zugabe von Antikoagulanzien und anderen Additiven. Blutkonzentrate können sowohl in einer soliden als auch in einer flüssigen Matrix hergestellt werden und bestehen aus Fibringerüsten mit einer konzentrierten Zahl an Leukozyten, Thrombozyten und Wachstumsfaktoren.
- Durch diesen konzentrierten Einsatz der natürlicherweise im Blut vorkommenden Wachstumsfaktoren wird die Wundheilung beschleunigt. Neben einer verbesserten Wundheilung führt der Einsatz von PRF oft zu geringeren ostoperativen Schmerzen und Schwellungen sowie zu einem verringerten Infektionsrisiko.
- Die regenerative Eigenschaft sowie das Handling von Biomaterialien, Knochenersatzmaterialien und Membranen lässt sich mit PRF erheblich verstärken, indem man vor der Anwendung diese mit körpereigenen Leukozyten, Thrombozyten und Wachstumsfaktoren eingebettet in einer hochpolymerisierten Fibrinmatrix in Form von flüssigen und/oder festen Phasen „biologisiert“.
Gilt das auch für Augmentationen mit autologen Knochenblöcken bzw. autologen Bindegewebstransplantaten? Lassen sie sich durch eine Blutkonzentrat-Matrix plus KEM ersetzen?
Becher: Gerade bei der Biologisierung und mechanischen Stabilisierung von partikulärem KEM sehe ich in Zukunft einen erheblichen Mehrwert durch PRF. Die Frage, ob sich in Zukunft autologe Knochenblöcke mit dieser Methode ersetzen lassen, lässt sich gegenwärtig auf Grund fehlender robuster Daten nicht beantworten.
Im Bereich der Rezessionsdeckung von Miller Klasse-I- und –II-Rezessionen (Typ I Rezessionen nach der neuen Klassifikation) ist die Verwendung von PRF und koronalem Verschiebelappen besser als nur der koronal verschobene Lappen.
Aktuelle Daten zeigen, dass die Ergebnisse in Bezug auf die prozentuale Deckung der Rezession als auch das Attachmentlevel gegenüber einem alleinigen koronalen Verschiebelappen besser sind, aber keinen Effekt auf die Zunahme an keratinisierter Mukosa hat. Bei einer entsprechend breiten präoperativen keratinisierten Mukosa erscheint die Therapie gingivaler Rezessionen mittels koronalem Verschiebelappen plus PRF als eine adäquate Alternative zum Freien Bindegewebstransplantat (FBGT) bei natürlich deutlich reduzierter Morbidität. Liegt präoperativ eine geringe Zone an keratinisierter Mukosa vor, sollte der koronale Verschiebelappen mit einem freien Bindegewebstransplantat kombiniert werden.
Das Ganze klingt nach einem umfassenden Protokoll. Wie haben Sie das alles in Ihren täglichen Workflow integriert?
Becher: Tatsächlich ist das Prozedere sehr einfach in den Praxisalltag zu integrieren. Das ist unter anderem auf die geringen technischen Voraussetzungen zurückzuführen. Die einzelnen Handgriffe müssen allerdings sitzen, das gilt es im ganzen Team zu trainieren. Da keine Antikoagulantien eingesetzt werden, ist der Aspekt der Zeit sehr wichtig und darf nicht unterschätzt werden.
Worauf kommt es dabei an?
Becher: Da PRF ohne Antikoagulantien hergestellt wird, müssen die Röhrchen direkt nach der Blutabnahme in die Zentrifuge gegeben werden. Der Prozess der Abnahme vom ersten bis zum letzten Röhrchen sollte nicht mehr als zwei Minuten betragen, da dies sonst zu einem reduzierten Ergebnis, sprich kleinerem Clot führen kann.
In der Regel können bis zu sechs Röhrchen in einem Arbeitsgang verarbeitet werden. Werden mehr benötigt, gibt es auch dafür spezielle Lösungen. Wichtig ist, dass die Zentrifuge auf einem stabilen und festen Untergrund steht, da sich Vibrationen negativ auswirken.
Welche Studien belegen die jeweiligen Protokolle? Viele Anwender sprechen von „Bauchgefühl“ in diesem Zusammenhang?
Becher: Für den Anfang der „PRF-Ära“ trifft das auch zu. Inzwischen existieren zu vielen Indikationsbereiche aber schon sehr gute Daten, die den Nutzen von PRF belegen. Vor allem die Arbeitsgruppen um Prof. Dr. Dr. Dr. Sharam Ghanaati, Universität Frankfurt, und Prof. Dr. Marc Quirynen, Universität Leuven, Belgien, bringen das Thema gegenwärtig auf hohem wissenschaftlichen Niveau extrem voran. Eine gute Übersicht zu den verschiedenen Evidenzleveln in diversen Indikationsbereichen gibt die Übersichtsarbeit von Ghanaati et al. aus 2018.
Muss der Zahnarzt bestimmte regulatorische Vorschriften beachten? Unter anderem in der Pandemie? Gibt es in diesem Zusammenhang aktuelle Änderungen?
Becher: Die Anwendung von PRF und autologen Blutkonzentraten in der Praxis ist nach § 67 des AMGs der jeweiligen zuständigen Landesbehörde vor Aufnahme der Tätigkeit anzuzeigen. Die erlaubnisfreie Gewinnung bzw. Herstellung von Blutkonzentraten ist nur zulässig, soweit es unter der unmittelbaren fachlichen Verantwortung des persönlich anwesenden Arztes/Zahnarztes gewonnen bzw. hergestellt wird (§ 13 Abs. 2b AMG).
Die allgemeinen und aktuell speziellen Hygienerichtlinien sind zudem zwingend zu beachten.
Wie binden Sie Ihr Team ein?
Becher: Sehr aktiv, unsere Arzthelferinnen führen bestimmte Schritte wie die Blutentnahme sowie die Bedienung der Zentrifuge unter unserer Aufsicht selbstständig durch. Auch das Team nimmt die Anwendung und die Möglichkeit der aktiven Mitarbeit bei der PRF-Methode sehr positiv war. Beim Blutabnehmen gibt es in der Regel anfangs noch Übungsbedarf, da dies in den meisten Zahnarztpraxen noch nicht zum Tagesgeschäft gehört. Da ohne Antikoagulantien gearbeitet wird und der Aspekt der Zeit ein entscheidender Faktor zum Erfolg ist, ist ein Training im Team sehr zu empfehlen. Ratsam ist auch, die einzelnen aufeinanderfolgenden Schritte zum Beispiel in einer Checkliste aufzuführen. Dies reduziert enorm die technische Fehleranfälligkeit.
Wie ist die Patientenakzeptanz?
Becher: Sehr hoch. Patienten empfinden die Anwendung von PRF durchgehend als sehr positiv und sind immer recht erstaunt, was so alles aus ihrem Blut hergestellt werden kann! Die Punktion der Vene empfinden die Patienten in der Regel als recht unproblematisch.
Wie rechnen Sie die PRF-Behandlung ab, es handelt sich ja nicht um eine GKV-Leistung?
Becher: Entweder als Analogleistung gemäß § 6 Abs. 1 GOZ oder als Leistung auf Verlangen §2 Abs. 3 GOZ. Eine Erstattung über private Kostenträger ist unserer Erfahrung nach derzeit nicht gegeben, sodass auch Privatpatienten über entstehende Kosten aufgeklärt werden müssen.
Der Ausblick: Was muss geschehen, damit die PRF-Behandlung flächendeckend zum Standard-Protokoll aufsteigt?
Becher: Die Anwendung und Herstellung von PRF an sich ist einfach und die Ergebnisse sind sehr reproduzierbar. Doch es braucht mehr Evidenz und einheitliche Protokolle. Denn oftmals sind die Studienergebnisse in den unterschiedlichen Indikationsbereichen sehr heterogen, sodass für die Zukunft weitere gut designte Studien (einheitliche und vergleichbare Protokolle) nötig sind, um die offenen Fragen mit validen Daten zu beantworten.
In Zukunft sollten die Studien also das Bauchgefühl und die klinischen Beobachtungen der Anwender mit Daten untermauern. Die Arbeitsgruppen um Ghanaati wie auch Quirynen arbeiten seit 2014 resp. 2016 sehr intensiv daran, klinisch relevante Fragestellungen zu den oben erwähnten Anwendungsbereichen mit robusten Daten zu untermauern als auch innovative Indikationen zu untersuchen. Ich bin also sehr zuversichtlich. Generell lässt sich sagen, dass die Anwendung von leukozyten- und thrombozytenreichen Fibrinmatrices den Weg in den klinischen Alltag unserer Praxis gefunden haben und sinnvoll bestehende Therapiekonzepte ergänzen und vor allem in der Augmentationschirurgie vorhandene Grenzen bei Reduktion der Patientenmorbidität verschoben werden können.
Die Herstellung von leukozyten- und thrombozytenhaltigem PRF ist im Endeffekt sehr simpel, unabhängig vom System. Mit der Intraspin-Zentrifuge lässt sich die flüssige und feste Phase in einem einzigen Zentrifugationsprozess herstellen.
- Die Zentrifuge läuft bei 2700 Umdrehungen pro Minute für zwölf Minuten, nach drei Minuten erklingt ein akustisches Signal – für die Herstellung der flüssigen Phase. Die entsprechenden Vakuetten (weiß) werden zu diesem Zeitpunkt entnommen. Wichtig: Für die flüssige Phase braucht es kunststoffbeschichtete Röhrchen (weiß), keine glasbeschichteten wie für die feste Phase (rot).
- Nach Ablauf der zwölf Minuten entstehen die Clots in den glasbeschichteten Reagenzgläschen und können entnommen und weiterverarbeitet werden. Bei antikoagulierten Patienten hat sich eine Verlängerung der Zentrifugation bis zu 18 Minuten bewährt.
- Für die Socket-Preservation nach Zahnextraktion zur Förderung der Wundheilung benötigt man zwischen zwei und vier Vakuetten, je nach Größe der Alveole. Pro Vakuette kann dann entweder eine Membran oder ein Plug hergestellt werden, sprich: Eine Vakuette ist eine Verarbeitungseinheit.
- Werden vier Weisheitszähne entfernt, wird Blut für acht Röhrchen entnommen, um jede Alveole mit zwei Membranen oder Plugs aufzufüllen.
- Bei der Augmentationschirurgie reichen im Durchschnitt sechs Röhrchen Eigenblut, vier Röhrchen für die feste und zwei für flüssige Phase. Der Clot wird zur Membran weiterverarbeitet, diese wird kleingeschnitten, mit Knochenersatzmaterial wie beispielsweis BioOss vermischt und mit der flüssigen Phase benetzt und koaguliert.
Der Experte

Foto: Privat
Dr. Sebastian Becher
Fachzahnarzt für Parodontologie, Schwerpunkte Implantologie und Parodontalchirurgie, MVZ Kieferchirurgie Königsallee, Düsseldorf
www.kieferchirurgie-koenigsallee-duesseldorf.de