Nichtchirurgische Periimplantitistherapie
Als Hauptursache für parodontale und periimplantäre Erkrankungen wird die Akkumulation eines pathogenen Biofilms an der Wurzeloberfläche bzw. Implantatoberfläche angesehen, was zu einer Immunreaktion und einer darauffolgenden Resorption des Weich- und Hartgewebes führen kann [11].
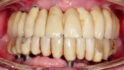
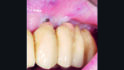
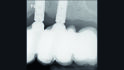
01a – Ausgangssituation mit implantatgetragenen Vollkieferversorgungen im Ober- und Unterkiefer. Im Unterkiefer ist ein früherer periimplantärer Knochenverlust ersichtlich, zum Zeitpunkt der Überweisung zeigt sich aber eine stabile und entzündungsfreie Situation. Die radiologische Untersuchung wies im Oberkiefer auf periimplantären Knochenverlust an den Implantaten in Position 23 und 24 hin (b).
Nach Optimierung der häuslichen Mundhygiene und Reduktion von etwaigen Risikofaktoren stellt die subgingivale Instrumentierung das Kernelement in der Behandlung von parodontalen und periimplantären Erkrankungen dar. Ziel der Behandlung ist die erfolgreiche Entfernung des subgingivalen Biofilms.
Im Praxisalltag kann man so bei parodontalen Defekten sehr vorhersagbare Ergebnisse erzielen; im Schnitt erzielt man an drei von vier Stellen ein erfolgreiches Therapieergebnis [19]. Bei periimplantären Defekten ist die Therapieerfolgsrate jedoch wesentlich geringer und vor allem schlechter voraussagbar. Dies hat mehrere Ursachen, beispielsweise die Gewindestruktur und Oberflächenmodifikation bei Implantaten, die im Gegensatz zur relativ glatten Oberfläche von Zahnwurzeln für Instrumente sehr schwer zugänglich sind und mit klassischen Handinstrumenten kaum effizient gereinigt werden können.
Deshalb führen nichtchirurgische Therapieansätze bei Periimplantitis in nur 14 bis 47 % der Fälle zu einer Ausheilung der Erkrankung [13,15]. Dementsprechend häufiger müssen bei periimplantären Defekten im Vergleich zu parodontalen Defekten chirurgische Ansätze gewählt werden – resektiv, rekonstruktiv oder eine Kombination von resektiv und rekonstruktiv.
Zur Behandlung von periimplantären Erkrankungen gibt es aktuelle europäische S3-Leitlinien [5], die einen guten Überblick über die derzeit verfügbare Evidenz geben. Zugleich zeigen sie aber auch auf, dass sehr viele Behandlungsansätze und -empfehlungen noch auf wissenschaftlich dünnen Beinen stehen und dementsprechend groß ist das Interesse an neuen Behandlungsoptionen. Im Folgenden liegt der Fokus auf neuen Ansätzen für die nichtchirurgische Periimplantitistherapie sowie einem Fallbeispiel, in dem ein nicht-chirurgischer Behandlungsansatz mit einer adjuvanten Therapieoption und einer Korrektur eines Weichgewebedefekts kombiniert wird.
„Problemstelle“ Implantatoberflächendekontamination
Die suffiziente Entfernung des Biofilms und des infizierten Granulationsgewebes stellt im Rahmen der nichtchirurgischen Periimplantitistherapie die größte Schwierigkeit dar. In Laborstudien hat sich sehr deutlich gezeigt, dass selbst unter optimalen Laborbedingungen eine vollständige Entfernung des Biofilms von der Implantatoberfläche kaum zu erwarten ist [6,10,16]. Dementsprechend häufig werden im klinischen Alltag lokale und/oder systemische Zusätze getestet mit variierendem Erfolg [5].
In den letzten Jahren hat sich eine Produktkombination als adjuvante Therapieform sowohl in der nichtchirurgischen Therapie von parodontalen als auch periimplantären Defekten empfohlen; vor allem im parodontalen Bereich auch bereits mit sehr breit aufgestellter wissenschaftlicher Evidenz. Dabei handelt es sich um die Kombination eines Reinigungsgels auf Basis von Natriumhypochlorit (NaOCl; Perisolv, Regedent) und einem wundheilungsfördernden Gel basierend auf vernetzter Hyaluronsäure (xHyA; HyadentBG, Regedent). Das Reinigungsgel besteht aus einer 0,95%igen NaOCl-Lösung, die vor Gebrauch mit einer Aminosäurelösung gepuffert wird. Dieses Reinigungsgel unterstützt die Entfernung des Biofilms [9], sowohl auf Dentin- als auch auf Implantatoberflächen [1]. Durch eine wiederholte Applikation des Reinigungsgels in der gleichen Sitzung wird das Granulationsgewebe aufgeweicht und leichter entfernbar [1]. Zusätzlich ist das NaOCl-Reinigungsgel durch die Pufferung mit einer Aminosäurelösung gut verträglich und es sind keine gewebereizenden Eigenschaften beschrieben.
Die Kombination aus subgingivaler Instrumentierung mit adjuvanter Applikation dieses Reinigungsgels hat bei parodontalen Defekten im Vergleich zur alleinigen subgingivalen Instrumentierung die klinischen Ergebnisse signifikant verbessern können [8]. Eine initiale Verbesserung der klinischen Parameter durch die zusätzliche Anwendung des Reinigungsgels zeigte sich auch in der Behandlung von periimplantärer Mukositis [7]. Der Anteil an erfolgreich behandelten und entzündungsfreien Implantaten lag in der Gruppe mit dem Reinigungsgel nach einem Monat bei 70 % gegenüber 53 % in der Kontrollgruppe. Jedoch zeigte sich, dass dieses initial gute Ergebnis nicht über einen längeren Zeitraum stabil gehalten werden konnte; nach sechs Monaten waren nur noch 45 % der Implantate in der Gruppe mit dem Reinigungsgel und 32 % in der Kontrollgruppe entzündungsfrei.
Aus diesem Grund scheint auch – vor allem bei periimplantären Defekten und rezidivierenden parodontalen Defekten – eine Kombination mit einem die Wundheilung und Regeneration fördernden Produkt vielversprechend.
Vernetzte Hyaluronsäure zur Unterstützung
Hyaluronsäure (HA) ist ein natürlicher Bestandteil unseres Körpers und spielt eine entscheidende Rolle in der Wundheilung. Diese Eigenschaft hat sich vor allem in der Therapie von parodontalen Defekten bereits als vorteilhaft erwiesen, sowohl basierend auf histologischen Daten von präklinischen Studien [17,18] als auch basierend auf parodontalen Parametern in klinischen Studien [2,4,14]. Durch ihren starken „Klebeeffekt“ bindet HA das Blut im Defektraum und unterstützt somit eine optimale Stabilisierung des Wundbereichs (1 g HA kann bis zu 6 l Wasser binden) [12]. Darüber hinaus weist vernetzte HA auch eine bakteriostatische Wirkung auf mehrere orale Keime auf, was wiederum das Risiko einer erneuten Infektion minimieren sollte [3,20].
Die kombinierte Anwendung des Natriumhypochlorit-Reinigungsgels und der vernetzten HA (Clean&Seal) als adjuvante Therapieform zur subgingivalen Instrumentierung bei unbehandelten Parodontitispatienten, zeigte signifikante Vorteile. Die klinischen Parameter unterschieden sich ca. 1 mm zugunsten der adjuvanten Therapieform (subgingivale Instrumentierung mit Clean&Seal) [14]. Wenn auch die wissenschaftliche Datenlage bei periimplantären Defekten noch fehlt, erscheint eine Übertragung dieses Konzepts auf die nichtchirurgische Therapie von periimplantären Defekten sinnvoll und wird im folgenden Patientenfall beschrieben.
Fallbeispiel
Ein 67-jähriger Patient wurde zur Behandlung von Periimplantitis an zwei der sechs Implantate der Oberkieferversorgung überwiesen. Der Patient verfügt bereits über Erfahrung mit periimplantären Infektionen an den Implantaten im Unterkiefer, die sich aber nach erfolgreicher Behandlung stabil und entzündungsfrei halten (Abb. 1a). Im Oberkiefer wies die radiologische Untersuchung einen periimplantären Knochenverlust bei den Implantaten in Position 23 und 24 auf (Abb. 1b).
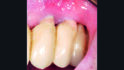
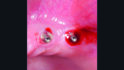
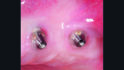
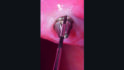
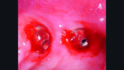
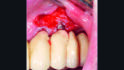
Die klinische Untersuchung führte bei Druck im Vestibulum zu Suppuration an beiden Implantaten in Position 23 und 24 (Abb. 2a) und nach Abnahme der Suprakonstruktion zeigten sich erhöhte Sondierungstiefen mit bis zu 6 mm sowie Blutung und Suppuration nach Sondierung (Abb. 2b–d). Zusätzlich wies vor allem das Implantat in Position 24 einen Mangel an keratinisierter und fixierter Mukosa auf. Bei beiden Implantaten wurde die Diagnose Periimplantitis gestellt.
Nach Optimierung der häuslichen Mundhygiene wurden beide Implantate mechanisch mittels Pulverstrahlgerät mit Glycinpulver gereinigt und direkt danach die Clean&Seal Behandlung als adjuvante Therapieform durchgeführt. Hierzu wurde Perisolv subgingival rund um die Implantate appliziert und für 60 Sek. belassen. Danach wurden die Läsionen sowie die Implantatoberfläche mit Titanküretten instrumentiert; dieser Behandlungsschritt wurde insgesamt fünfmal durchgeführt. Nach Spülung mit steriler Kochsalzlösung wurde HyadentBG sub- und supragingival appliziert und die prothetische Versorgung wieder eingesetzt (Abb. 3).
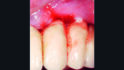
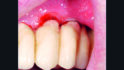
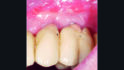
Die nächste Kontrolle wurde nach zwei Monaten durchgeführt. Bei dieser Kontrolle wurde die Suprakonstruktion erneut abgenommen und die klinische Situation zeigte bereits eine signifikante Verbesserung mit Sondierungstiefen ≤ 3 mm und keine Suppuration (Abb. 4).
Jedoch zeigte sich nach wie vor eine minimale Tendenz zur Blutung nach Sondierung. Aus diesem Grund wurde nach einer erneuten supragingivalen Reinigung mit einem Pulverstrahlgerät HyadentBG ein zweites Mal appliziert (Abb. 5).
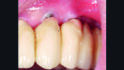
Nach weiteren drei Monaten (5-Monatskontrolle) wurde die nächste Kontrolle und unterstützende Implantattherapie durchgeführt. Nun zeigte sich nach Abnahme der Suprakonstruktion ein entzündungsfreies periimplantäres Weichgewebe, keine Sondierungstiefen > 3 mm, keine Blutung nach Sondieren und kein Pusaustritt (Abb. 6).
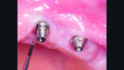
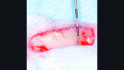
Aufgrund des weiterhin bestehenden Mangels an keratinisierter und fixierter Mukosa am Implantat in Position 24 wurde eine Weichgewebechirurgie mit einem freien Schleimhauttransplantat zur Wiederherstellung der keratinisierten und fixierten Mukosa und zur Vertiefung des Vestibulums durchgeführt (Abb. 7).
Die Einheilung des freien Schleimhauttranplantats verlief komplikationslos (Abb. 8) und acht Monate nach der Behandlung mit Clean&Seal wies die klinische und radiologische Kontrolle im Rahmen der unterstützenden Implantattherapie auf periimplantäre Gesundheit sowie eine Verbesserung des periimplantären Knochenniveaus hin (Abb. 9).
Der Patient wird nun weiterhin zur regelmäßigen, unterstützenden Implantattherapie einbestellt. Im ersten Jahr wird versucht ein Intervall von drei bis vier Monaten beizubehalten. Danach kann dieses Intervall je nach häuslicher Mundhygiene und anderen Risikofaktoren eventuell verlängert werden.
Zusammenfassung
Die nichtchirurgische Therapie von periimplantären Defekten mit einer adjuvanten Kombinationstherapie zeigt in der Praxis vielversprechende Ergebnisse. Hierbei wird die Implantatdekontamination mithilfe eines Reinigungsgels auf Natriumhypochloritbasis verbessert sowie durch die „Versiegelung“ nach der Reinigung mit vernetzter Hyaluronsäure die Wundheilung gefördert. Wie im Patientenfall gezeigt, ist bei periimplantären Erkrankungen das Problem aber oft vielschichtig und so sollten beispielsweise Weichgewebedefizite korrigiert werden, um das Ergebnis langfristig stabil halten zu können.

PD Dr. Kristina Bertl
ist als Oberärztin an der Abteilung für Parodontologie im Krankenhaus Blekinge in Karlskrona, Schweden, sowie an der Sigmund Freud Privatuniversität in Wien tätig. Nach ihrer Habilitation 2014 und dem Master of Science in Parodontologie erwarb sie einen MBA im Bereich Gesundheitsmanagement.
Als Vorstandsmitglied der Österreichischen Gesellschaft für Parodontologie (ÖGP) und Mitglied des erweiterten Vorstands der Österreichischen Gesellschaft für Implantologie (ÖGI) ist sie national und international aktiv. Zudem ist sie Sekretärin des Scientific Affairs Committee der European Federation of Periodontology und Autorin von rund 80 Publikationen in wissenschaftlichen Fachzeitschriften.
Foto: privat