Probiotika: Gesunde Keime gegen Parodontitis
Seit Jahren rückt das humane Mikrobiom immer mehr in den Fokus der Wissenschaft. Es beschreibt die Summe aller Gene von Mikroorganismen, die den Menschen besiedeln. Die Erkenntnis, dass nicht primär pathogene Keime Krankheiten verursachen, sondern der „Mix“ an Bakterien, hat auch die Ursachenforschung der Parodontitis beeinflusst. Probiotika könnten vor diesem Hintergrund eine Behandlungsalternative darstellen.
Harald Löe, Professor am Royal Dental College in Aarhus, Dänemark, und seine Mitarbeiter veröffentlichten 1965 eine Studie, bei der sie in einem Humanexperiment nachwiesen, dass ein kausaler Zusammenhang zwischen Plaqueakkumulation und Gingivitisaufkommen besteht.
Diese und weitere Studien prägten jahrzehntelang das Verständnis über die Zusammenhänge von Prophylaxe, Gingivitis und Parodontitis. „Wir haben bisher immer gedacht, dass die Plaque-Bakterien die Entzündung verursachen und die richtige Prävention darin bestehe, die Zähne immer schön sauber zu halten“, sagt Prof. Dr. Ulrich Schlagenhauf, Leiter der Abteilung für Parodontologie der Universität Würzburg. Viele klinische Untersuchungen zeigten aber auch, dass bei Weitem nicht jede ungestörte Plaque-Akkumulation zur Entwicklung einer Gingivitis führt. „Es gibt viele Patienten, die haben einen Haufen Beläge auf den Zähnen und da blutet nichts.“ Was machten diese Patienten anders?
Dysbakterie als Ursache
Porphyromonas gingivalis (P.g.) ist ein gramnegativer, proteolytischer Keim, der eng mit der Entstehung von parodontalen Entzündungen verbunden ist. Sein Auftreten in höherer Zahl in Zahnfleischtaschen zeigt ein erhöhtes parodontales Erkrankungsrisiko an. P.g. kann jedoch häufig auch in geringer Zahl im oralen Biofilm von parodontal gesunden Menschen nachgewiesen werden.
Alle Schleimhäute des Körpers zeigen an ihrer Oberfläche eine Besiedlung mit Mikroorganismen, vor denen sie jedoch unter „normalen“ Bedingungen durch die Bildung einer nur schwer durchdringbaren Schleimschicht geschützt sind. Diese Schleimschicht bietet wiederum vor allem nicht pathogenen und nützlichen Mikroorganismen gute Lebensbedingungen. Diese nützlichen Keime erschweren als „Platzhalter“ eine Ansiedlung pathogener Keime auf den Schleimhäuten. Ungünstige Bedingungen, wie beispielsweise Fehlernährung oder chronischer Stress, beschädigen die bakterienabweisende Funktion dieser Schleimschicht und bewirken, dass pathogene Keime in größerer Zahl und Häufigkeit in direkten Kontakt mit den Zellen der Schleimhaut gelangen, diese angreifen und schädigen.
Dies wiederum führt zum vermehrten Einwandern von Entzündungszellen in das Bindegewebe der Schleimhäute und zur Freisetzung entzündungsförderlicher Enzyme und Botenstoffe. Von den Entzündungszellen freigesetzte Abwehrstoffe wie die Proteine des Komplementsystems sind hochwirksame Moleküle zur Abtötung vom Keimen, die in den Körper eingedrungen sind. Schlagenhauf: „Eine Entzündungsreaktion, die durch das Eindringen von P.g. in die Schleimhaut ausgelöst wurde, hat jedoch keine schützende Wirkung, da P.g. über Virulenzfaktoren verfügt, die Komplementproteine inaktivieren können.“ So ist die Entzündung eigentlich kontraproduktiv und tötet vor allem die gegen Komplement nicht geschützten, nicht pathogenen und damit „guten“ Bakterien, die die natürlichen bakteriellen Gegenspieler von P.g. bilden. Das führt zur Entstehung gingivaler Blutungen, die P.g. wiederum als Nahrungsquelle zum weiteren Überwachsen nutzen kann. „Der Einsatz von Probiotika greift genau hier ein“, sagt Schlagenhauf.
Was sind Probiotika?
Probiotika sind Lebensmittelzubereitungen, die lebende Mikroorganismen wie etwa Milchsäurebakterien enthalten, die die teils sehr sauren Bedingungen des Magens überstehen und eine gesundheitsförderliche Wirkung auf den Körper ausüben. Durch die Bildung spezifischer antibakteriell wirkender Substanzen, können probiotische Bakterien das Wachstum pathogener Keime wie etwa P.g. direkt hemmen und so indirekt auch die von den Pathogenen ausgelöste Entzündungsreaktion dämpfen.
Schlagenhauf: „Darüber hinaus sind verschiedene probiotische Keime vermutlich auch in der Lage, direkt die Aktivierung von Entzündungszellen in unserem Körper zu beeinflussen. Ergebnisse aus Studien konnten zeigen, dass der Verzehr von Probiotika Einfluss auf die Verteilung der Zahl entzündungshemmender und entzündungsförderlicher Lymphozyten nehmen kann.“
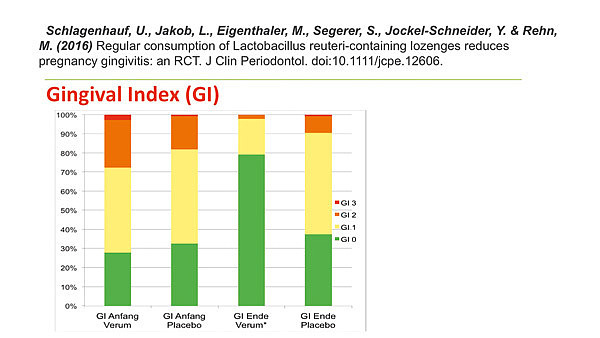
An der Universität Würzburg führten Prof. Schlagenhauf und seine Mitarbeiter bereits mehrere kontrollierte klinische Studien zur Bewertung des Einflusses probiotischer Lactobacillus-reuteri-Keime auf Entzündungen im Mund durch. Sie zeigten durchweg eine ganz ausgeprägte Hemmung der gingivalen Entzündung sowie einen sehr deutlichen Rückgang der bakteriellen Zahnbeläge. Schlagenhauf: „Die Ergebnisse sind auch deswegen so erstaunlich, weil wir in allen diesen Studien den beteiligten Studienpatienten keinerlei Informationen oder Anleitungen zur Intensivierung ihrer meist deutlich verbesserungsbedürftigen häuslichen Zahnpflege gegeben hatten.“
Milde Nebenwirkungen
Probiotika-Aufbereitungen in Form von Kaugummis, Spülungen und Lutschtabletten, die als Nahrungsergänzungsmittel frei verkäuflich sind, können bei regelmäßiger Einnahme die Symptome einer Parodontitis hemmen. Das haben nicht nur die Forschungsarbeiten aus Würzburg bewiesen. Auch bei Karies, so hat eine schwedische Studie gezeigt, kann die Einnahme von Probiotika das Kariesrisiko senken. Ein weiterer Vorteil von Probiotika gegenüber herkömmlicher Parotherapien mit Antibiotika oder Chlorhexidin: „In den bisherigen Probiotika-Studien zeigten sich, wenn überhaupt, nur milde Nebenwirkungen wie etwa Blähungen und/oder ein Völlegefühl in der Anfangsphase der Einnahme“, führt Ernährungswissenschaftlerin Dr. Henrike Staudte aus.Vor diesem Hintergrund könnten Probiotika prinzipiell dauerhaft genommen werden, sind sich die Experten einig. Auch vor dem Hintergrund, dass noch keine Langzeitstudien vorliegen.
Wenn man das Immunsystem ganzheitlich betrachtet, wird schnell klar, dass Probiotika in Form von Nahrungsergänzungsmitteln trotz aller positiver Effekte lediglich eine kurzfristige Therapieoption darstellen. „Durch die Einnahme der Probiotika in Bonbon- oder Kaugummiform wird lediglich eine kurzfristige Verschiebung der Bakterienflora zum Positiven hin erreicht. Wenn aber eine Dysbiose, also eine unerwünschte Veränderung der Bakterienflora im Darm, vorliegt, wird es langfristig wieder schlechter werden“, stellt Dr. Rudolf Meierhöfer fest, der Fortbildungen im Bereich Ganzheitliche Parodontologie und Ernährung anbietet. „Das sagt auch die klassische Gastroenterologie: Es gibt eine klare Beziehung zwischen dem darmassoziierten und dem schleimhautassoziierten Immunsystem.“
Gezielte Anamnese
Eine gesunde Darmflora, eine entsprechende Ernährung und gar nicht primär die Zahl der Beläge spielen eine wichtige Rolle für die Mundgesundheit. Das bewies auch eine Studie vom Schweizer Forscher Stefan Baumgartner und seinen Kollegen sehr eindrücklich. Im Rahmen eines Formats im Schweizer Fernsehen lebten zehn Menschen für vier Wochen unter steinzeitlichen Bedingungen.
Es gab keinen Zucker und die Speisen konnten nur über offenem Feuer und ohne moderne Küchenutensilien zubereitet werden. Keinem der Teilnehmer standen innerhalb der vier Wochen Zahnbürste, Zahnpasta oder andere Mundhygieneprodukte zur Verfügung. Und obwohl der Plaque-Index der Versuchspersonen im Durchschnitt von 0,68 auf 1,47 anstieg, kam es zu einer Reduktion der mittleren BOP Scores von 34,8 auf 12,6 Prozent. So ergab die Analyse der bakteriellen Flora zwar einen Anstieg der Gesamtkeimzahl, jedoch zugunsten nicht parodontalpathogener Spezies.
Archäologische Funde stützen die Ergebnisse der Baumgartner-Studie: Plaques von 7.000 Jahre alten Zähnen zeigen, dass sich mit dem Beginn des Ackerbaus die orale Mikroflora veränderte und die Artenvielfalt der Keime im Mundraum sukzessive verringerte. Das ermöglichte es Krankheitserregern, den Mundraum ungehinderter zu besiedeln, die dann Zahninfektionen verursachten. Probiotika sowie eine abwechslungsreiche Ernährung können helfen, die bakterielle Vielfalt wieder herzustellen.
Für die Praxis bedeutet dies: „Um herauszufinden, ob eine Dysbiose im Zusammenhang mit einer Parodontitis vorliegt, ist es wichtig, dies in der Anamnese gezielt abzufragen und dem Patienten ein Ernährungstagebuch anzuordnen“, empfiehlt Meierhöfer. Lässt sich ein Zusammenhang feststellen, sei es indiziert, eine Stuhlprobe machen zu lassen. „Auf der Grundlage dieser Ergebnisse kann man dann gezielt genau die Probiotika beispielsweise in Form von Kapseln zuführen, die fehlen.“ Zusätzlich müsse der Patient seine Ernährung umstellen. Das heißt konkret, zu viele übersäuernde Lebensmittel wie Fleisch, Kaffee oder kohlensäurehaltige Getränke vermeiden und durch einen höheren Anteil an basischen und antioxidativen Lebensmitteln wie Obst und Gemüse ersetzen.
Ausblick
Neue wissenschaftliche Erkenntnisse haben gezeigt, dass Parodontitis auch Elemente einer Autoimmunerkrankung aufweist. Probiotika in Form von Nahrungsergänzungsmitteln können der Dysbakterie im oralen Biofilm und im Darm kurzfristig entgegenwirken oder die Beschwerden von Parodontitispatienten in stressigen Episoden lindern. Langfristig hilft jedoch nur eine Ernährungsumstellung.
Die positiven Effekte von Probiotika in Bezug auf die Parodontitistherapie wurden bereits in vielen Studien dokumentiert, doch es fehlen Langzeitstudien. Auch der Einfluss anderer Lebensmittel in Bezug auf Parodontitis sollte weitergehend erforscht werden. So gibt es bereits Studien, die sich mit der Aufnahme von Ballastoffen in Zusammenhang mit der Parodontitistherapie beschäftigen. Schlagenhauf: „Die Forschung steckt hier aber noch in den Kinderschuhen.“ Auch die Erforschung des Mikrobioms wird in Zukunft noch weiter vorangetrieben werden und wertvolle Erkenntnisse für die Medizin und Zahnmedizin mit sich bringen. Neue technische Möglichkeiten der Gensequenzierung haben die Forschung so günstig gemacht, „dass die Mikrobiom-Forschung zu ersten Mal für größer angelegte Studien mit 50 oder 100 Probanden interessant wird, die man über einige Monate begleiten und dann Aussagen darüber treffen kann, welche Bakterienkonstellation sich als protektiv erweist und welche nicht“, hofft Schlagenhauf.