Vom Patientenprofil zum Präventionskonzept
Schon lange ist bekannt, dass ein bidirektionaler Zusammenhang zwischen Mund- und Allgemeingesundheit besteht. Eine alleinige Betrachtung der oralen Situation ist nicht ausreichend und nicht mehr zeitgemäß. Wie sich mit der Berücksichtigung und Betrachtung der individuellen Patientenparameter ein individuelles Risikoprofil erstellen lässt, zeigt Dr. Romana Krapf aus Weißenhorn am Fall eines 28-jährigen Patienten.
Die genaue Anamnese und Befundung von Allgemeingesundheit und Mundgesundheit sowie deren gemeinschaftliche Betrachtung sind unabdingbar, um ein individuelles, fallorientiertes Präventions- und Patientenprofil zu erstellen (Abb. 1) [1–3].
Ein patientenindividuelles Risikoprofil hilft dabei, den Erhalt der Gesundheit und der Lebensqualität des Patienten optimal zu unterstützen und auch dem Behandler eine Planungssicherheit zu geben.
Anhand der vorliegenden Fallpräsentation kommt die Systematik des individuellen Präventionskonzepts zur Erstellung eines fallorientierten Patientenprofils und sich daraus ergebenden Therapiemaßnahmen zur Anwendung. Im folgenden Fall wird ein 28-jähriger Patient vorgestellt.
Anamnese
Laut eigenen Angaben war der Patient im Jugendalter Leistungssportler. Er gibt an, früher bis zu 3–4 Liter isotonische Getränke über den Tag verteilt getrunken zu haben. Seit ca. einem Jahr hat er dies eingestellt. Heute trinkt er Wasser sowie Schwarztee.
Allgemeinmedizinisch zeigt der Patient keine Grunderkrankungen. Er berichtet, im Frühjahr an Heuschnupfen zu leiden. Je nach Bedarf nimmt er saisonbedingt Antiallergika ein. An Asthma leidet der Patient nicht. Der Patient ist Raucher mit bis zu zehn Zigaretten pro Tag seit acht Jahren. Er pflegt 2x pro Tag seine Zähne mit einer elektrischen Zahnbürste und nimmt 1x täglich Interdentalbürstchen für die Zahnzwischenräume. Der Patient legt viel Wert auf seine Zähne. Er befindet sich in der präventiven Nachsorge und kommt 3x jährlich in die Praxis.
Befundung
Extra- und Intraoraler Befund: Extraoral sind keine pathologischen Befunde festzustellen, intraoral zeigen sich bei der Frontalansicht im Bereich der keratinisierten Gingiva und am Übergang zur beweglichen Schleimhaut bräunliche Verfärbungen, welche auf den Nikotingenuss zurückzuführen sind. Am Gaumenbereich zeigen sich insbesondere im Bereich Oberkiefermolaren palatinal weißliche Schleimhautveränderungen, die ein Hinweis auf einen erhöhten Verhornungsgrad sind und ebenso auf den Nikotingenuss zurückzuführen sind. Die Zunge ist mit einem weiß-bräunlichen abwischbaren Belag versehen.
Dentaler Befund: Dental zeigt sich ein vollbezahntes Gebiss mit 28 Zähnen. Auffällig sind Erosionen und Attritionen. Der Patient trägt seit vielen Jahren nachts eine Schiene mit adjustiertem Aufbiss aufgrund Bruxismus. Die Erosionen sind auf den langjährigen Konsum isotonischer Getränke zurückzuführen. Parodontaler Knochenverlust und aktive kariöse Läsionen sind nicht vorhanden.
Parodontaler Befund: Die klinischen Sondierungstiefen liegen mit 1–3 mm im physiologischen Bereich. Im Oberkiefer zeigen sich von 13–16 sowie 23–27 Rezessionen bis 1 mm. Der BOP liegt bei 15 %.
Radiologischer Befund: Es zeigt sich ein vollbezahntes, kariesfreies Erwachsenengebiss ohne radiologisch erkennbaren Knochenabbau. Radiologischer Schmelz- und Höckerverlust sind insbesondere an 36 und 37 festzustellen.
Behandlungsempfehlung: individuelles Präventionskonzept
Entscheidend ist vor der Behandlung das individuelle Risikoprofil des Patienten zu beurteilen. Das individuelle Patientenprofil ergibt sich aus der allgemeinen Anamnese und der Mundgesundheit.
Aufgrund der allgemeinen Anamnese ist das Komplikationsrisiko während der Behandlung sowohl für Patient als auch Behandler als gering einzustufen. Das orale Erkrankungsrisiko ist derzeit aufgrund des Rauchens mit bis zu zehn Zigaretten pro Tag moderat einzustufen. Rauchen birgt ein erhöhtes Parodontitisrisiko [4] und ein erhöhtes Risiko an karzinogenen Tumoren zu erkranken.
Aus Sicht der Mundgesundheit ist das Progressions- bzw. Entstehungsrisiko für eine Verschlechterung des oralen Zustandes und der Ausbildung einer möglichen parodontalen Erkrankung als mäßig einzustufen. Auch hier ist das Rauchen ein ausschlaggebender Faktor. Eine gute häusliche Mundpflege und eine konsequente regelmäßige professionelle Sitzung in der Zahnarztpraxis mit einer motivierenden Ansprache sind ausschlaggebend für den Erhalt des stabilen Zustandes.
Unter Berücksichtigung des Rauchens hat der Patient ein moderates Erkrankungs- und Entstehungsrisiko für orale Erkrankungen. Aufgrund des guten allgemeinmedizinischen Zustands ist der aus der Mundgesundheit ermittelte Bedarf maßgebend für die Behandlung.
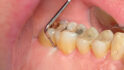
Die regelmäßige Erhebung der Sondierungstiefen ist unabdingbar. Die gingivale Blutung ist bei Rauchern herabgesetzt, weswegen die klinische Diagnose einer Parodontitis nur durch Sondierung möglich ist (Abb. 2). Die ausschließliche Erhebung von Blutungsindizes verdecken unter Umständen das Bild einer bestehenden Parodontitis oder Gingivitis [5].
Parodontalstatus erheben
Einmal jährlich ist ein ausführlicher Parodontalstatus zu erheben. Ein Plaquebefund mit einem Anfärbemittel kann zur Motivation erhoben werden. Die Beurteilung der intraoralen Befunde, der Wangen und Zungenschleimhaut spielen insbesondere beim Raucher eine wichtige Rolle, um mögliche pathologische Veränderungen frühzeitig zu erkennen [6].
Eine fotografische Dokumentation ermöglicht, den zeitlichen Verlauf einer potenziellen krankhaften Schleimhautveränderung zu beurteilen. Gegebenenfalls ist hier die Überweisung zu einem Spezialisten notwendig, um eine Gewebeprobe durchführen zu lassen. Zudem stützen bildgebende Verfahren das Motivationsgespräch mit dem Patienten. Besserungen können im Verlauf der nachfolgenden Präventionssitzungen aufgezeigt werden.
Instruieren und motivieren
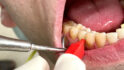
Instruktion und Motivation sind wichtige Bestandteile in der Sitzung. Gutes häusliches Mundhygieneverhalten und -verständnis sind dem Patienten wichtig. Es zeigen sich insbesondere an den Zahnhalsbereichen Plaqueakkumulationen. Diese sind mit dem Patienten zu besprechen und Verbesserungen in der Zahnputztechnik zu üben. Gerade aufgrund der Erosionen und Attritionen ist ein weicher Zahnbürstenaufsatz für die häusliche Mundhygiene anzuraten. Zugleich ist es notwendig die Interdentalraumbürstchen, welche der Patient täglich verwendet, nach der richtigen Größe zu überprüfen und den Patienten zu bestärken, diese konsequent zu benutzen (Abb. 3). Eine gute Mundhygiene ist unabdingbar, um das Parodontitisrisiko aufgrund des Rauchens zu minimieren.
Eine Motivation liegt weiterhin in der Zungenreinigung, um den Nikotin- und Bakterienbelag zu entfernen und den möglicherweise daraus resultierenden Mundgeruch zu vermeiden. Ein maßgeblicher Schwerpunkt liegt selbstverständlich auch darin, eine Hilfestellung und motivierende Beratung zur gewünschten Verhaltensänderung bezüglich des Rauchens zu geben.
In der Instrumentierung der Therapiesitzung ergeben sich bezüglich der Methodenwahl aufgrund des gesunden Allgemeinzustands des Patienten keine Einschränkungen. Gegebenenfalls ist in der Allergiephase individuell abzuklären, ob der Patient Einschränkungen beim Atmen hat. In diesem Fall ist abzuwägen, ob das Pulverstrahlgerät zum Einsatz kommen sollte.
Ziel: Den Biofilm entfernen
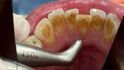
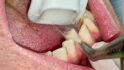
Ziel ist es, durch supra- und subgingivale Biofilmentfernung das Erkrankungsrisiko zu kontrollieren. Die Wahl der Instrumente erfolgt bedarfsgerecht. Zunächst sind Zahnstein und ggf. Konkremente mit Ultraschall und/oder Handinstrumenten zu entfernen (Abb. 4). Die Raucher- und Teeverfärbungen lassen sich mittels Pulverstrahl gut entfernen. Abrasivere Pulver sind nur bei intaktem Zahnschmelz anzuwenden [7]. Somit ist deren Verwendung im vorliegenden Fall wegen der Erosionen und Attritionen kritisch zu hinterfragen bzw. sehr lokalisiert einzusetzen (Abb. 5).
Bei Verwendung des höher abrasiven Pulvers ist dringend darauf zu achten, von zervikal nach koronal zu arbeiten und die Auslassdüse niemals in Richtung Gingiva zeigen zu lassen, um eine mögliche Emphysembildung zu vermeiden. Eine gegenüberliegende gute Absaugung ist unabdingbar zur Reduktion des Aerosols (Abb. 6). Weiterer Biofilm kann mittels niedrig abrasiven Glycinpulvern entfernt werden. Nach Anwendung des höher abrasiven Pulvers ist eine Nachpolitur notwendig (Abb. 7).
Geeignete Polierpasten mit entsprechend schonenden RDA-Werten und unterschiedlichen Inhaltsstoffen verschließen und glätten Unebenheiten der Zahnoberfläche ohne Zahnsubstanz massiv abzutragen. Gleichzeitig werden so natürliche und künstliche Besiedelungsnischen für die bakterielle Wiederanhaftung reduziert [8]. Inhaltsstoffe der Polierpasten können zudem Substanzen zur unterstützenden Therapie beinhalten: Fluoride, Zinkverbindungen und ätherische Öle gegen Hypersensitivität, Halitosis und Kariesprophylaxe.
Eine Zahnzwischenraumreinigung mit Interdentalbürstchen oder Zahnseide zur interdentalen Biofilmentfernung ist in der Therapiesitzung unabdingbar (Abb. 8). Ebenso ist es notwendig eine Zungenreinigung durchzuführen, um bakterienreiche Zungenbeläge sowie Tee- und Raucherbeläge zu entfernen (Abb. 9). Die Anwendung eines Zungengels ist sinnvoll. Diese enthalten meistens Zink-, Zinnverbindungen, die antibakteriell wirken.
Fluoridierung
Als adjuvante Maßnahme empfiehlt sich eine Fluoridierung der freiliegenden Wurzeloberflächen und der Erosionen zur Kariesprävention. Bei der Wahl der Fluoridierung ist auf die freiliegenden Zahnhälse zu achten. Im besten Fall sollte eine Fluoridierung mit neutralem pH-Wert gewählt werden.
Weitere Schritte sind das Beibehalten einer fluoridhaltigen Zahnpasta zur häuslichen Mundhygiene und die zusätzliche Maßnahme eines Fluorid-Gels. Fluorid dient zur Remineralisation und trägt zur Desensibilisierung von freiliegendem Dentin bei. Die Zahnpasta sollte von geringer Abrasivität sein, um den fortgeschrittenen Schmelzverlust nicht weiter zu fördern.
Nachsorge planen
Für die Planung der Nachsorgeintervalle sind die Faktoren Mundgesundheit, Lebensstil und allgemeiner Anamnese zu berücksichtigen. Der Patient wird durch das Rauchen im „Risikoprofil 3 Lebensgewohnheiten” eingestuft. Er liegt mit zehn Zigaretten am Tag an der Grenze vom moderaten Erkrankungsrisiko zum erhöhten Erkrankungsrisiko. Daraus ergibt sich ein Nachsorgeintervall von 2–3x pro Jahr. Dieses Intervall wird bei Veränderungen im Bedarf entsprechend angepasst, um eine Über- oder Unterversorgung zu vermeiden. Ziel ist es, keine weiteren Zahnhartsubstanzverluste zu erzeugen und den Patienten zu motivieren, die Rauchgewohnheiten zu reduzieren und bestenfalls zu eliminieren.
Eine gute Patientenführung ist ein ausschlaggebender Punkt für den nachhaltigen Erfolg und die Gesundheit des Patienten. Eine unmittelbare weitere Terminvergabe in der Praxis ist sinnvoll und dringend ratsam.
Zusammenfassung
Aufgrund des geringen Komplikationsrisikos aus der Anamnese ist zum jetzigen Zeitpunkt während der Behandlung sowohl für den Patienten als auch den Behandler in der Erhaltungstherapie keine Besonderheit zu beachten.
Das Entstehungs- und Erkrankungsrisiko für eine mögliche Verschlechterung des oralen Zustandes ist als mäßig einzuschätzen. Hier spielt das Rauchen eine ausschlaggebende Rolle.
Die Befundaufnahme in der Therapiesitzung stellt einen wichtigen Bestandteil dar. Ein Blutungsstatus (BOP) ist in jeder Sitzung erforderlich, um parodontale Taschentiefen frühzeitig zu erkennen. Dies ist beim Raucher von besonderer Wichtigkeit aufgrund der mangelnden Durchblutung des Gewebes.
Ein Schwerpunkt liegt in der Motivation des Patienten zur Verhaltensänderung im Hinblick auf das Rauchen. Eine Remotivation der häuslichen Mundpflege ist unabdingbar. Dies ist ein wichtiger Beitrag zur Prävention einer möglichen Parodontitis und von Kariesläsionen.
Aufgrund des mäßigen oralen Erkrankungsrisikos ist ein 4–6-monatiges Therapieintervall zu empfehlen. Die Entfernung von harten und weichen Belägen ist unabdingbar zum Erhalt der jetzigen Situation. Ein weiterer Zahnhartsubstanzverlust soll unbedingt vermieden werden.

Dr. Romana Krapf M. Sc.
ist in Gemeinschaftspraxis mit Dr. Werner Krapf niedergelassen. Zu ihren Behandlungsschwerpunkten gehören die Parodontologie, Prophylaxe und Zahnerhalt mit präventiver Zahnheilkunde und Ästhetik. Sie ist Referentin im Bereich Prophylaxe, Vorstandsmitglied im zahnärztlichen Bezirksverband Schwaben und Dozentin an der DTMD – University Luxembourg.
www.drkrapf.de
Foto: privat