PA-Therapie: Lokale Antibiotika
Entzündliche Parodontalerkrankungen werden nicht nur wegen einer Verbesserung der Patientencompliance heute weitaus weniger aggressiv behandelt als früher. Neben optimaler Mundhygiene und SRP können – bei Nachweis von PA-Markerkeimen – auch lokal zu applizierende „keimtötende“ Präparate als unterstützende Therapiemaßnahme eingesetzt werden.
Studien haben gezeigt, dass sich mit rein mechanischen Maßnahmen (SRP) potenziell pathogene Keime nicht vollständig aus einer Parodontaltasche eliminieren lassen [Mombelli A. et al.].
Sind Lokalantibiotika die Lösung?
Ratka-Krüger: Lokale Antibiotika sind ein ergänzendes Therapiemittel zur nicht-chirurgischen mechanischen Parodontitistherapie. Sie kommen vor allem im Rahmen des Recalls zum Einsatz. Ich wende bevorzugt bei Patienten in der unterstützenden Parodontitistherapie mit einzelnen Resttaschen zusätzlich zu Scaling und Wurzelglättung ein lokales Antibiotikum an.
Roßberg: Auch ich setze lokale Antibiotika bevorzugt bei Recallpatienten mit einzelnen persistierenden oder rezidivierenden Taschen mit Sondierungstiefen ≥ 5 mm und „Bluten auf Sondieren“ ein. In den meisten Fällen erfolgt dies zusätzlich zur mechanischen Instrumentierung der Wurzeloberfläche.
Was funktioniert lokal appliziert besser als systemisch?
Ratka-Krüger: Für mich liegen die Vorteile vor allen Dingen in der geringen systemischen Belastung, der kontrollierten Compliance und der hohen Wirkstoffkonzentration, die lokal erreicht werden kann.
Bürklin: Es lässt sich lokal einfach gezielter und mit geringeren Nebenwirkungen therapieren. Man kann sich einzelne Zähne bzw. Stellen mit erhöhter Sondierungstiefe und Bluten auf Sondieren separat vornehmen und erreicht – wie Frau Prof. Ratka-Krüger schon betonte – eine sehr hohe Wirkstoffkonzentration, ohne den Gesamtorganismus zu belasten.
Frau Dr. Leyer, was sagen Sie aus Sicht des Herstellers?
Leyer: Ich schließe mich an. Bei immer wieder neu aufflammenden Entzündungsprozessen in einzelnen tiefen Taschen sind lokale Antibiotika zur ergänzenden Behandlung indiziert. Denn die mechanische Therapie hat klare Grenzen: Die in Dentinkanälchen [Adriaens PA et al.] oder Parodontalgewebe eingewanderten parodonthal-pathogenen Keime lassen sich durch rein mechanische Therapie nicht komplett entfernen [Christersson LA et al.]. Das Auftreten systemischer Nebenwirkungen (wie z. B. Diarrhoe) ist bei lokaler Applikation des Antibiotikims sehr unwahrscheinlich.
Herr Dr. Gaßman, Sie sind zurückhaltender?
Gaßmann: Gemäß der Stellungnahme der Deutschen Gesellschaft für Zahn-, Mund- und Kieferheilkunde sollten nur solche Antibiotika lokal appliziert werden, die in geeignete Trägersubstanzen eingebettet extra für die Bedingungen in der parodontalen Tasche konzipiert sind. Und bisher kann nicht von einer prinzipiellen Indikationsstellung für die Anwendung der lokalen antibiotischen Therapie im Rahmen der konservativen Parodontitistherapieausgegangen werden.
Was bedeutet das für die Praxis?
Gaßmann: Aktuell wird sogar diskutiert, ob durch die adjunktive lokale antibiotische Medikation nach dem SRP die Notwendigkeit späterer parodontalchirurgischer Interventionen eingeschränkt werden kann. Und die aktuelle Studienlage zeigt, dass sich sowohl durch die adjunktive systemische als auch die lokale antibiotische Therapie statistisch signifikant bessere Ergebnisse nach der konservativen Therapie mittels SRP erzielen lassen. Dabei liegt der Vorteil der Tetrazyklinderivate wie Doxyzyklin und Minozyklin darin, dass sie nicht nur eine antimikrobielle Wirkung entfalten, sondern sich auch beispielsweise durch die Hemmung der Bildung von Matrixmetalloproteinasen positiv auf die Reaktion des Wirtsgewebes auswirken [Grenier D, Park JB].
In welchen konkreten Fällen favorisieren Sie die lokale Gabe?
Gaßmann: Grundsätzlich vorstellbar ist diese Therapie in der Erhaltungstherapie in der Behandlung von residualen Taschen, bei denen sich gezeigt hat, dass Scaling und Wurzelglättung (SRP) allein in der vorangegangenen Beobachtungszeit nicht zum gewünschten Erfolg geführt hat – da schließe ich mich den Kollegen an, darüber hinaus in Fällen mit aggressiver Parodontitis und bei Patienten mit durch systemische Erkrankungen geschwächter Wirtsantwort [Mombelli A].
Was sagen Sie, Frau Dr. Leyer?
Leyer: Ligosan Slow Release ist indiziert bei chronischer und aggressiver Parodontitis bei Erwachsenen, bei Taschen ≥ 5 mm als Unterstützung der konventionellen nicht-chirurgischen Parodontitistherapie.
Als größtes Übel bei Antibiotikagaben gilt bekanntlich die Resistenzbildung …
Dombrowa: Dieses Risiko ist bei der lokalen Antibiose vergleichsweise gering.
Aufgrund der hohen intrasulkulären Wirkstoffkonzentration?
Dombrowa: Richtig, diese Konzentration kann die systemische Gabe nicht erreichen.
Welche Rolle spielt die Applikationsform dabei?
Dombrowa: Eine wesentliche! Denn der Therapieerfolg ist unabhängig von der Patientencompliance.
Bitte konkretisieren Sie das, Frau Dr. Leyer.
Leyer: Bei der lokalen Antibiotikagabe sollte eine Applikationsform gewählt werden, bei der eine therapeutische Wirkstoffkonzentration über einen ausreichenden Zeitraum gewährleistet werden kann*, um die Entstehung von Resistenzen zu verhindern. *Genau dies konnte für Ligosan Slow Release in Studien gezeigt werden [Kim TS et al.].
Bekanntlich steigt das Risiko der Resistenzbildung, wenn Antibiotika in zu geringer Dosierung eingesetzt oder die Behandlung zu früh abgebrochen wird …
Leyer: Ja, und dieses Risiko entfällt bei der Gabe eines entsprechenden lokalen Antibiotikums. Der Patient kann die Einnahme nicht vergessen. Ligosan Slow Release beispielsweise wird einmal appliziert. Eine zweite Sitzung zur Entfernung des Gels erübrigt sich, da es biologisch zu harmlosen Substanzen abgebaut wird.
Bürklin: Die Wirkungsdauer ist zudem bei Ligosan Slow Release für einen Zeitraum von zwölf Tagen nachgewiesen, bei nur einmaliger Applikation.
Roßberg: Weitere Vorteile sehe ich in der möglichen Schonung der Zahnhartsubstanz und den daraus resultierenden geringeren Zahnhalsüberempfindlichkeiten. Dies könnte durch eine Reduzierung der mechanischen Behandlung der Taschen aufgrund des Einsatzes lokaler Antibiotika erreicht werden. Denn ähnlich gute Ergebnisse erzielt bereits die lokale Antibiotikagabe, also ohne mechanische Wurzelbearbeitung. Darüber hinaus ist die systemische Belastung bei Behandlung vereinzelter Taschen durch lokale Antibiotika relativ gering.
Wie steht es mit Nebenwirkungen?
Ratka-Krüger: Bei richtiger Indikationsstellung gibt es praktisch weder Nachteile noch Nebenwirkungen. In ganz seltenen Fällen kam es lokalisiert zu einer geringen Entzündungsreaktion der marginalen Gingiva.
Also kann man lokale Antibiotika unbedenklich einsetzen?
Ratka-Krüger: Ja, aber man sollte sie nicht unreflektiert in jede tiefe Tasche einbringen. Vor allem gilt: Zuerst den Biofilm entfernen, erst dann wird das lokale Antibiotikum appliziert.
Zu viel des Guten könnte also gefährlich werden?
Gaßmann: Das kann so kommen. Der bekannte, grundsätzliche Nachteil, der sich aus einer flächendeckenden Anwendung von Antibiotika in der Parodontitistherapie- sei sie lokal oder systemisch – ergibt, ist ja die früher oder später zu erwartende Resistenzbildung mit all ihren zu bedenkenden Konsequenzen in der Bekämpfung tödlicher bakterieller Infektionen. Neben diesen fatalen, die Allgemeinheit treffenden Konsequenzen ist auch die Auswirkung von Antibiotika auf die Ausbildung oxidativen Stresses in den Körperzellen des Wirts zu bedenken.
Mit anderen Worten: Je mehr Taschen therapiert werden, desto höher das Risiko?
Roßberg: Ich denke ja. Der Wirkstoff ist dann im Blut deutlich nachweisbar, das heißt, er erscheint und wirkt verstärkt systemisch. Und damit erhöht sich auch auch das Risiko der Resistenzbildung. Der Patient kann auch allergisch auf die lokalen Antibiotika und deren Inhaltsstoffe reagieren. Das muss im Anamnesegespräch abgeklärt werden.
Frau Dr. Dombrowa, welche Komplikationen können auftreten?
Dombrowa: Die meisten Lokalantibiotika enthalten ein Breitspektrum-Antibiotikum als antibakteriellen Wirkstoff. Dies hat prinzipiell den Vorteil, dass alle potenziell pathogenen Keime sicher und effizient abgetötet werden. Allerdings wird dabei auch in Kauf genommen, dass gleichzeitig die benefiziellen Mikroorganismen, also auch jene Bakterien, die das gesunde Parodont dominieren und als physiologische Standortflora wichtig sind für die Aufrechterhaltung des oralen Milieus, eradiziert werden. Zu beachten ist ferner, dass bei Einsatz eines lokal wirkenden Antibiotikums die Wirkung weitgehend auf die Zahnfleischtasche beschränkt bleibt. Parodontalpathogene, die sich in anderen Retentionsnischen wie der Wangenschleimhaut, den Tonsillen oder dem Zungenrücken befinden, werden auf diese Weise ebenso wenig erreicht wie Bakterien, die über den Blutkreislauf in den Gesamtorganismus disseminiert sind.
Dann müssten lokale Antibiotika bei aggressiver Parodontitis, zum Beispiel mit mehr als zehn zu behandelnden Taschen, doch eher kontraindiziert sein?
Gaßmann: Meiner Ansicht nach gibt es noch wenige Untersuchungen zur Therapie von aggressiven Parodontitiden sowie zu Furkationsdefekten in Verbindung mit einer lokalen Antibiotikatherapie.
Leyer: Bei den generalisierten Formen der in der DGZMK-Stellungnahme genannten Parodontitiden sollte die Antibiotikagabe systemisch erfolgen. Denn dann werden entfernt liegende bakterielle Reservoirs wie z. B. die Tonsillen erreicht. Lokal verabreichte Antibiotika haben zwar den Vorteil, dass sie den Patienten nicht systemisch belasten und wesentlich höhere Konzentrationen in der entsprechenden Tasche erzielen können. Aufgrund der geringen systemischen Belastung werden allerdings bakterielle Reservoirs, die nicht in unmittelbarer Umgebung der behandelten Parodontaltasche liegen, nicht erreicht.
Zur Applikation der unterschiedlichen Präparate: Worauf kommt es an?
Ratka-Krüger: Entscheidend ist die Praktikabilität, sprich: Wie einfach lässt sich das lokale Antibiotikum bzw. das Antiseptikum in die Tasche bringen. In der lokalen Therapie werden heute Chlorhexidin, Metronidazol, Minozyklin und Doxyzyklin eingesetzt, die sich bei der Anwendung vor allem in Applikationsform und Wirkdauer unterscheiden.
Gaßmann: Die Applikation muss hygienisch einwandfrei, schnell und einfach zu bewerkstelligen sein. Diesen Prinzipien genügen die auf dem Markt verfügbaren Präparate. Aber auch für den Patienten sollte die Wirkstoffapplikation möglichst angenehm sein, nicht schmerzen, nicht zu lange dauern und weder die Nahrungsaufnahme noch den Geschmack beeinträchtigen.
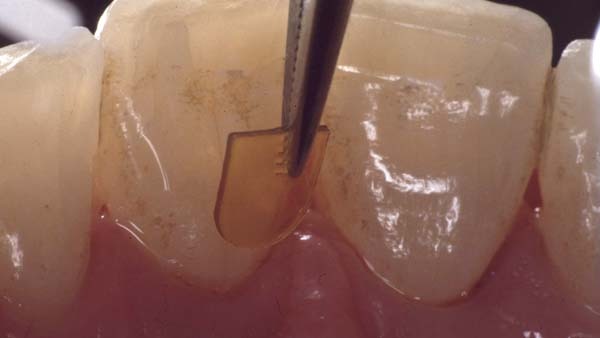
Bürklin: Bei Ligosan erfolgt die Applikation direkt in die Tasche. Dies ist bei tieferen Taschen und stärkerer Entzündung einfacher, weil das Gewebe weniger straff ist. Die direkte Applikation über eine Kanüle ist sicher und leicht erlernbar.
Dombrowa: Das Einbringen eines Lokalantibiotikums ist allerdings sicher aufwendiger als das Schlucken einer Tablette. Mit ein wenig Übung stellt es aber – das sehe ich wie Dr. Bürklin – kein Problem dar.
Wie sieht es mit den Kontrollintervallen aus?
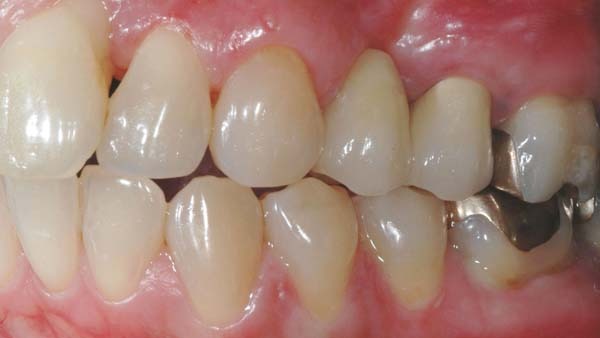
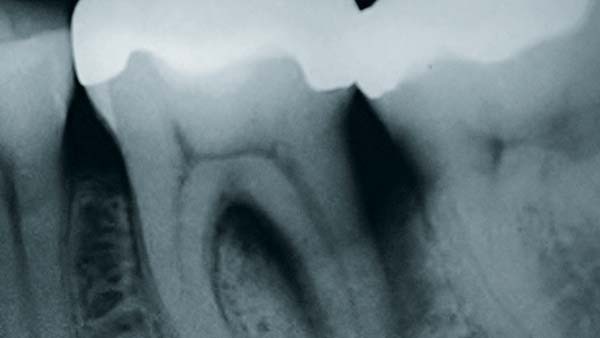
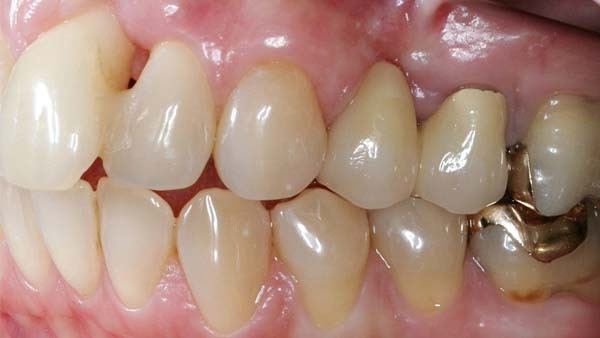
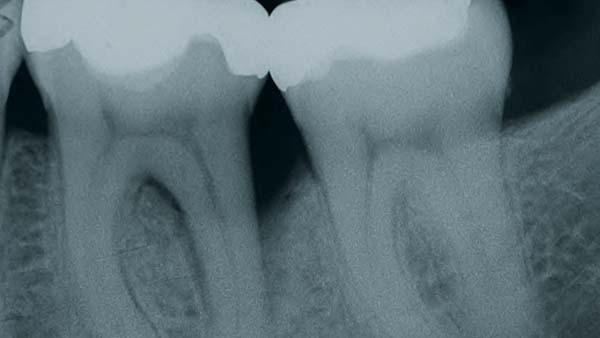
Roßberg: Der Zeitaufwand für notwendige Kontrollintervalle sollte gering gehalten werden. Nimmt man z. B. das Doxyzyklinpräparat Ligosan, das über ein synthetisches Polymerträgergel appliziert wird, zeigt sich eine leichte Anwendbarkeit. Ligosan bringt zusätzlich zur mechanischen Therapie bessere klinische Ergebnisse. Eine ähnlich gute Anwendung hat auch Arestin. Es enthält den Wirkstoff Minozyklin in Polyzykloid-Polymer-Kugeln und wird als Pulver subgingival eingebracht (Abb. 4a).
Welche Relevanz hat die Wirkstofffreisetzung?
Dombrowa: Sie ist enorm wichtig. Damit die Antibiotikakonzentration über einen ausreichend langen Zeitraum oberhalb der minimalen Hemmstoffkonzentration (MHK) liegt, ist es notwendig, dass das Therapeutikum über eine retardierte Freisetzung verfügt. Sogenannte „controlled release devices“ sind in der Lage, den Wirkstoff über mehr als 24 Stunden hinweg dosiert abzugeben. Bei Applikationsformen, die die antibakterielle Substanz auf einmal freisetzen, verpufft die Wirkung, weil sie durch die Sulkusflüssigkeit sofort wieder aus der Tasche herausgespült wird. Um der Entstehung von Resistenzen vorzubeugen, ist es wichtig, dass die MHK zudem ausreichend hoch ist, um vorhandene Bakterien effizient abzutöten. Ist sie zu niedrig, kann einer Resistenzbildung sogar Vorschub geleistet werden.
Leyer: Die Art der Wirkstoffapplikation ist von entscheidender Bedeutung, was auch die gemeinsame Stellungnahme der Deutschen Gesellschaft für Parodontologie (DGParo) und der Deutschen Gesellschaft für Zahn-, Mund- und Kieferheilkunde (DGZMK) herausstellt.
Ligosan als 14%-iges Doxyzyklingel erfüllt mit seiner Hydrogel-Matrix diese Anforderungen. Das Gel wird in zunächst niedrigviskoser Konsistenz in die Tasche eingebracht und verbleibt durch Erhöhung seiner Viskosität in wässriger Umgebung zuverlässig am Wirkort. Der Wirkstoff wird nach einmaliger Applikation aus der biologisch abbaubaren Hydrogel-Matrix kontinuierlich und in ausreichend hoher Menge für die Dauer von mindestens zwölf Tagen freigesetzt [Kim TS et al.].
Welche wissenschaftlichen Studien belegen den Erfolg in der Parodontologie und in der Periimplantitistherapie?
Ratka-Krüger: In einem kürzlich erschienenen Review wurde die Wirksamkeit von lokalen Antibiotika bei der Behandlung chronischer Parodontitis beleuchtet (Matesanz-Pérez et al. 2013). Auf der Basis von 52 Studien kommen die Autoren zu der Schlussfolgerung, dass lokale Antibiotika in Kombination mit mechanischer Therapie eine signifikante klinische Wirksamkeit zeigen, insbesondere bei tiefen Taschen oder Resttaschen.
Gaßmann: Die Zahl der wissenschaftlichen Studien zum adjunktiven Einsatz lokal zu applizierender antibiotischer Trägersysteme ist sehr groß und lässt sich in diesem Rahmen nur ansatzweise darstellen. Dabei kommen die unterschiedlichsten Antibiotika zum Einsatz. So werden positive Effekte sowohl für Azithromycin [Agarwal E et al.], Clarithromycin [Bajaj P, Pradeep AR], Doxyzyklin [Eickholz P et al.] und Minozyklin sowohl für die Parodontitistherapie [Bland PS et al.] als auch für den Einsatz in der Periimplantitistherapie [Renvert S] beschrieben. Es steht außer Frage, dass sich durch den Einsatz lokaler Antibiotika das Behandlungsergebnis in der konservativen Therapie der chronischen Parodontitis verbessern lässt. Aber die Frage ist, wie sinnvoll es ist, wenn in Deutschland 60.000 Zahnärzte fortan, animiert und inspiriert durch die Option zur Taschenminimierung, ihre Parodontitistherapie lokal antibiotisch begleiten [Mombelli A].
Leyer: Die aktuellen Ergebnisse einer Anwenderbeobachtung bestätigen die klinischen Wirksamkeitsstudien. Auch unter Praxisbedingungen ist durch den Einsatz von Ligosan Slow Release eine signifikante Reduktion der Sondierungstiefen und eine Verbesserung des Attachment-Levels erzielbar (siehe Infokasten „Klinische Wirksamkeit“, Seite 21)
Wie verbreitet ist denn die lokale Antibiose bei PA-Patienten aktuell?
Leyer: Eine Abschätzung zur Verbreitung von lokalen unterstützenden Behandlungen ist äußerst schwer. Zahlen von der GfK deuten aber auf mittlerweile mehr als 40.000 Behandlungen in Deutschland pro Jahr.
An dieser Stelle ist die Aufklärung des Patienten durch den Zahnarzt hinsichtlich Risiko und Kosten-Nutzen-Analysevon essenzieller Bedeutung. In einer Befragung von Patienten ergab sich, dass eine Parodontitis für einen Patienten eine erhebliche Krankheitslast aufweist und er/sie dann auch gerne klaren Therapieempfehlungen des behandelnden Zahnarztes/der behandelnden Zahnärztin Folge leistet. Dann werden auch Zusatzkosten gerne akzeptiert, so das Ergebnis interner Daten, Heraeus Kulzer GmbH.
40.000 Behandlungen pro Jahr, ist das nicht ausgesprochen wenig?
Ratka-Krüger: Richtig, ich kenne zwar keine Zahlen, glaube aber, dass die lokale Antibiotikatherapie nicht weit verbreitet ist.
Wie kommt das?
Ratka-Krüger: Vielen Kollegen fehlen einfach entsprechende Informationen.
Liegt es eventuell auch an den Kosten? Die lokale Antibiotika-Behandlung ist teuer und keine Kassenleistung.
Ratka-Krüger: Es ist richtig, die Kosten sind verhältnismäßig hoch. Dennoch wählen einige meiner gesetzlich versicherten Patienten nach Aufklärung über verschiedene Behandlungsoptionen – Nachscaling ohne lokales Antibiotikum, Lappen-Operation – bewusst das lokale Antibiotikum und sparen sich dadurch oft weitere parodontalchirurgische Eingriffe.
Gaßmann: Ich denke, es kommt auf das Know-how und die Überzeugungskraft des Zahnarztes an. Ist er in der Lage, glaubhaft zu erklären, warum in diesem individuellen Fall die Maßnahme sinnvoll beziehungsweise für den langfristigen Therapieerfolg unerlässlich ist, wird der Patient sie auch bezahlen wollen.
Herr Dr. Roßberg, Herr Dr. Bürklin, wie überzeugen Sie Ihre Patienten von der Therapievariante ?
Roßberg: In unserer Praxis werden Patienten fast ausschließlich in der unterstützenden Parodontitistherapie mit lokalen Antibiotika behandelt. Da lässt sich eine Notwendigkeit gut vermitteln. Die Patienten haben zu diesem Zeitpunkt schon eine umfassende Therapie erhalten, das steigert die Akzeptanz und die Compliance. Meist beschränkt sich in dieser Phase die Therapie auf nur wenige Taschen. Für viele Patienten sind auch die verbesserte Taschenreduktion und die teilweise vermeidbare Anästhesie durch die lokale Anwendung der Antibiotika ein weiterer Grund, der Behandlung zuzustimmen. Die Verbreitung der Therapie, da gebe ich den Kollegen recht, ist eher gering. Mögliche Gründe:
- Unsicherheiten bei der Indikationsstellung
- die Frage des richtigen Zeitpunkts der Behandlung innerhalb der Parodontitistherapie
- weiterführende parodontalchirurgische Maßnahmen
Bürklin: Bei richtiger Auswahl stehen die zusätzlichen Kosten in gesunder Relation zum Behandlungserfolg. Für viele Patienten erübrigen sich so chirurgische Maßnahmen. Das spart wieder Geld. Im Übrigen sind die meisten Leistungen im Bereich der unterstützenden Parodontitistherapie keine Kassenleistungen. Unseren Patienten ist der Erhalt ihrer Zähne durchaus wichtig. Dafür sind sie dann auch bereit, etwas aus der eigenen Tasche zu investieren.
Frau Dr. Leyer, lokale Antibiotika sind für den Durchschnittspatienten zu teuer, ist der Preis zu hoch?
Leyer: Die Krankenkassen können leider nicht alle Behandlungsmöglichkeiten finanzieren, die die moderne Zahnmedizin zur Verfügung stellt. Die Anwendung systemischer Antibiotika ist seit zirka 1990 fester Bestandteil der Behandlung aggressiver und schwerer chronischer Parodontitiden. Die lokale Antibiose hat sich erst mit der Entwicklung geeigneter Trägersysteme, die es möglich machen, Antibiotika in geeigneter Dosierung und konstanter Freisetzung lokal zu applizieren, als neue Behandlungsmethode etabliert.
Auch wenn die systemische Antibiose in der Regel von der Krankenkasse übernommen wird, sollte sie auf Grund der möglichen Nebenwirkungen wie z. B. pseudomembranöse Kolitis oder Photosensibilisierung nur nach strenger Indikationsstellung eingesetzt werden.
Bei entsprechender Indikation empfiehlt sich die lokale Antibiose, bei der die systemische Belastung des Patienten auf ein Minimum reduziert werden kann.
Auch die Chlorhexidin-Behandlung per PerioChip ist in der lokalen Parodontitistherapie verbreitet, die Behandlung ist kostengünstig.
Frau Prof. Ratka-Krüger, nutzen Sie solche Alternativen?
Ratka-Krüger: Die Chlorhexidin-Behandlung bzw. den Perio-Chip wähle ich dann, wenn Patienten Resttaschen haben und ausdrücklich kein Antibiotikum wollen, weder lokal noch systemisch.
In Bezug auf klinische Ergebnisse, sprich Sondierungstiefenreduktion, liegt der PerioChip zusammen mit Metronidazol eher im unteren Bereich im Vergleich zu anderen Antibiotika [Matesanz-Pérez et al.]. In jüngster Zeit wurde ein neues Gel entwickelt, das mit Xanthan, einem schwer löslichen, chemisch stabilen und besonders viskösen Polysaccharid-Polymer, hergestellt wurde. Obwohl noch nicht viele Studien existieren, sind hier die klinischen Ergebnisse insbesondere in Bezug auf Attachmentgewinn deutlich besser [Matesanz-Pérez et al.]
Herr Dr. Gaßmann, viele Zahnärzte schwören auf Chlorhexidin in der unterstützenden PA-Erhaltungtherapie, warum?
Gaßmann: Die Zahnärzteschaft kann bei Chlorhexidin auf jahrzehntelange positive Erfahrung zurückgreifen. Die Wirksamkeit des Chlorhexidins ist nachgewiesen auf dem höchsten Evidenzniveau.
Aber die Therapie ist bei der PA-Behandlung nicht unumstritten?
Gaßmann: Umstritten ist der Einsatz des Chlorhexidinchips, weil auch er mit Nebenwirkungen und unerwünschten Nebeneffekten bis hin zur Ausbildung von Parodontalabszessen einhergeht. Auch konnte seine Effektivität nicht durchgängig dargestellt werden [Sakellari D et al.].
Es ist ja auch eigentlich nicht die Frage, ob sich durch den Einsatz eines solchen Chips – ausgeschüttet nach dem Gießkannenprinzip – statistisch signifikante Verbesserungen der Therapieergebnisse erzielen lassen, sondern ob seine Wirksamkeit in den Fällen demonstriert werden kann, in denen das SRP allein nicht zu dem vom Patienten zu wünschenden und vom Therapeuten zu erwartenden Behandlungserfolg geführt hat. Dies gilt gleichermaßen für andere Medikationen und deren Trägersysteme.
Roßberg: Die lokale Chlorhexidin-Behandlung mit PerioChip findet ihre Indikation ebenfalls hauptsächlich in der unterstützenden Parodontitistherapie. Die Reduktion der Taschen ist deutlich höher als allein mit mechanischen Maßnahmen. Auch die Gefahr von möglichen Nebenwirkungen, sehe ich nicht. Allerdings: Die Applikation verlangt Übung, da der Chip im Kontakt mit dem Speichel sehr klebrig wird und über diesen Effekt auch in der Tasche verbleiben soll.
Als Nachteil könnte man auch hier ggf. an die Kosten denken, da es sich nicht um eine Kassenleistung handelt. Des Weiteren ist eine Behandlung über mehrere Monate bei mehrfacher Applikation nötig, um einen signifikant besseren Effekt zu erzielen als mit der rein mechanischen Therapie, was wiederum eine engmaschigere Kontrolle bei guter Compliance des Patienten voraussetzt.
Funktionieren lokale Antibiotika besser?
Bürklin: Ich arbeite lieber mit lokalen Antibiotika. Die Applikation des PerioChips gestaltet sich etwas schwieriger, die Langzeitwirkung ist geringer.
Beim Chlorhexidin handelt es sich nicht um ein Antibiotikum, sondern um ein Antiseptikum …
Dombrowa: Richtig, CHX besitzt eine hohe Substantivität und gilt in Form von Gelen oder Spülungen vor allem in der PA-Nachsorge als Goldstandard in der Infektionsbekämpfung. Beim CHX-Chip handelt es sich um einen biologisch abbaubaren Träger auf Gelatinebasis, der mit 34 % Chlorhexidinbis-(D-Glukonat) beschickt ist. Laut Herstellerangaben wird der Wirkstoff über 72 Stunden abgegeben und die Erreger werden über drei Monate bekämpft.
Wie schätzen Sie den Erfolg dieser Behandlung ein?
Dombrowa: Klinische Studien und Reviews berichten bei Verwendung des Präparats über widersprüchliche klinische Ergebnisse. Ein Problem könnte hier vielleicht sein, dass das Trägermaterial über die Abgabe des Wirkstoffs hinaus in der Tasche verbleibt und dann als „Substrat“ für Bakterien dienen kann. Als Vorteil beim Einsatz des Chlorhexidin-Chips wird hervorgehoben, dass – im Gegensatz zu Lokalantibiotika – keine Gefahr für Resistenzbildungen besteht. Allerdings besteht eine solche auch bei Einsatz von Lokalantibiotika nicht, da die Konzentration in der Zahnfleischtasche so hoch ist, dass eine Resistenzbildung sicher ausgeschlossen werden kann.
Kommen wir zu den Grenzen der lokalen Antibiotikagabe. In welchen Fällen ist z. B. die systemische Gabe ein Muss?
Ratka-Krüger: In Fällen von schweren Formen einer Parodontitis, wie der aggressiven Parodontitis und der schweren chronischen Parodontitis. Insbesondere bei diesen Erkrankungsformen können bestimmte Keime wie Aggregatibacter actinomycetemcomitans aus der Tasche ins benachbarte Gewebe eindringen oder Regionen wie Zunge und Tonsillen besiedeln, die von mechanischer Parodontitistherapie oder auch von lokalen Antibiotika nicht erreicht werden.
Auch bei akuten Parodontalerkrankungen wie der Nekrotisierenden Ulzerierenden Gingivitis und Parodontitis (NUG, NUP) mit Allgemeinsymptomatik oder auch einem Parodontalabszess mit Ausbreitungstendenz in die benachbarten Logen, Fieber und/oder ausgeprägter Lymphadenopathie kommen systemische Antibiotika zum Einsatz. Kollegen, die unsicher bei der Verordnung von Antibiotika sind, sollten sich nach den gültigen Empfehlungen der DGParo und DGZMK richten.
Gaßmann: Die systemische Gabe von Antibiotika im Rahmen der systematischen Parodontitistherapie ist unerlässlich vor allem bei allgemeinmedizinisch bedingten Kompromittierungen wie in der Endokarditisprophylaxe und der medikamentösen Herabsetzung der Reaktionsfähigkeit des Immunsystems beispielsweise durch Cyclosporin nach Organtransplantationen. Sie kann ebenfalls im Fall eines schlecht eingestellten Diabetes [Grossi SG] und unter Bisphosphonattherapie [Ficarra G et al.] indiziert sein. Aus parodontaler Indikation ist sie im Fall der aggressiven Parodontitis das Mittel der Wahl [Sgolastra F].
Roßberg: Die systemischen Antibiotika können unterstützend bei Vorliegen bestimmter parodontaler Erkrankungsformen – wie der aggressiven Parodontitis und der schweren chronischen Parodontitis – verordnet werden. Hierbei ist der Keim Aggregatibacter actinomycetemcomitans von besonderer Bedeutung, da dieser aus der Tasche ins Gewebe eindringen und andere Regionen besiedeln kann, die von der mechanischen Parodontitistherapie nicht erreicht werden. Die Antibiotikatherapie sollte immer in Verbindung mit der vorausgehenden mechanischen Therapie erfolgen, um eine deutliche Bakterienreduktion im (zu diesem Zeitpunkt) desintegrierten Biofilm zu erzielen. Bei akuten Parodontalerkrankungen wie der Nekrotisierenden Ulzerierenden Gingivitis und Parodontitis (NUG, NUP) oder auch bei einem Parodontalabszess mit Ausbreitungstendenz in die benachbarten Logen, Fieber und/oder ausgeprägter Lymphadenopathie können ebenfalls die systemischen Antibiotika zum Einsatz kommen.
Wie häufig kommen die systemischen Antibiosen zum Einsatz? Gibt es da Zahlen oder Schätzungen?
Bürklin: In besonders schweren Fällen der chronischen Parodontitis und bei den aggressiven Formen der Parodontitis, oder in Kombination mit schweren Allgemeinsymptomen muss eigentlich immer auf systemische Antibiotika zurückgegriffen werden. Aber: Die systemische Antibiotikatherapie ist der mechanischen Biofilmentfernung untergeordnet.
Lokale Antibiotika bei generalisierter Parodontitis – würde das nicht letztlich die Kosten sprengen?
Dombrowa: Richtig – und zum anderen würde der Wirkstoff bei Therapie multipler Läsionen auch systemisch nachweisbar sein. Dies dann aber in einer Konzentration, die sich unterhalb der MHK befindet und somit der Bildung von Resistenzen Vorschub leisten würde. Liegt eine generalisierte Parodontitis mit multiplen Taschen ≥ 5 mm vor, sind die Sinngrenzen der Lokalantibiose erreicht. Auch eine Therapie mehrwurzeliger Zähne mit Furkationsbeteiligung ist mittels lokal applizierter Antibiotika eher schwierig. In diesen Fällen ist die unterstützende Therapie mit einem systemisch wirkenden Antibiotikum, das auf der Basis eines mikrobiologischen Tests ausgewählt wurde, die Therapie der Wahl. Dabei ist auch zu beachten, dass die systemische Verabreichung von Antibiotika – bei allen nicht zu vermeidenden Nebenwirkungen – auch PA-Bakterien erreicht, die sich außerhalb der Zahnfleischtasche befinden, und so einer Reinfektion ausgehend von extrasulkulären Bereichen eher vorbeugt.
Leyer: In der gemeinsamen Stellungnahme der Deutschen Gesellschaft für Parodontologie (DGP) und der Deutschen Gesellschaft für Zahn-, Mund- und Kieferheilkunde (DGZMK) sind die Indikationen für die unterstützende systemische Antibiotikagabe zur Therapie von Parodontitiden benannt:
- aggressive Parodontitis (AAP, 2000a)
- schwere chronische Parodontitis
- Parodontitiden, die trotz vorangegangener Therapie progrediente Attachmentverluste aufweisen (AAP, 2001)
- Parodontalabszess mit Tendenz zur Ausbreitung in die benachbarten Logen, Fieber und/oder ausgeprägter Lymphadenopathie (AAP, 2001, Dahlen, 2002)
- nekrotisierende ulzerierende Gingivitis oder Parodontitis mit ausgeprägter Allgemeinsymptomatik (Fieber und/oder ausgeprägte Lymphadenopathie) (AAP, 2001)
- mittelschwere bis schwere Parodontitis bei systemischen Erkrankungen oder Zuständen, die die Funktion des Immunsystems beeinträchtigen
Halten wir fest: In der Nachsorge sind rezidivierende oder lokale Resttaschen „Parade-Indikationen“ für die Behandlung mit einem Lokalantibiotikum. Gilt das auch nach parodontalchirurgischem Vorgehen?
Ratka-Krüger: Sofern auch nach parodontalchirurgischem Eingriff noch Resttaschen mit Entzündungszeichen vorhanden sind, kann im Rahmen der unterstützenden Parodontitistherapie ein lokales Antibiotikum eingesetzt werden.
Gaßmann: Eine Option für den Einsatz von antibiotischen lokalen Trägermaterialien nach parodontalchirurgischen Eingriffen ist nicht in deren direktem Umfeld, sondern unter Umständen in der sich anschließenden Erhaltungstherapie zu sehen.
Roßberg: Bei nicht-regenerativen parodontalchirurgischen Maßnahmen sollte ab dem Zeitpunkt der Reevaluation, zirka acht Wochen nach Therapie, über weitere therapeutische Maßnahmen entschieden werden. Bei regenerativen chirurgischen Therapien warte ich erste Sondierungstiefenmessungen ab. Die ST-Messung kann bis zu sechs Monate nach der Therapie stattfinden, um die entsprechende Notwendigkeit zu evaluieren. Eine lokale Antibiotikatherapie sollte ab Sondierungstiefen ≥ 5 mm bei Blutung in Betracht gezogen werden. Ausnahmen sind lokale akute Entzündungen. Liegen solche vor, sollte zu jedem Zeitpunkt über weitere therapeutische Maßnahmen entschieden werden. Voraussetzung sind in allen Fällen Mundhygiene und Compliance des Patienten.
Sehen Sie das ebenso, Herr Dr. Bürklin, Frau Dr. Leyer?
Bürklin: Ja, im Rahmen der Erhaltungstherapie, bei Resttaschen und Stellen mit Bluten auf Sondieren ist eine lokale Antibiotikatherapie auch nach vorangegangener chirurgischer Therapie empfehlenswert.
Leyer: Ich schließe mich an. Wird bei Recalluntersuchungen ein Rezidiv mit Taschentiefe ≥ 5 mm festgestellt, kann Ligosan erforderlichenfalls ergänzend eingebracht werden.
Wie sieht es in der Periimplantitistherapie aus?
Dombrowa: Ein Einsatz in Zusammenhang mit beginnender Periimplantitis wird diskutiert und ist generell denkbar. Allerdings sollte dieser erfolgversprechende Aspekt durch klinische Studien verifiziert werden.
Frau Prof. Ratka-Krüger, wird an den Hochschulen bereits geforscht?
Ratka-Krüger: Während lokale Antibiotika bei der Parodontitisbehandlung bereits sehr gut untersucht sind, fehlen bei der Periimplantitistherapie entsprechende Studien. Hier sehe ich Forschungsbedarf.
Woran hapert es?
Ratka-Krüger: An der Forschungsförderung im Bereich der Periimplantitistherapie.
In welchen Bereichen sehen Sie außerdem Forschungsbedarf?
Gaßmann: Ich sehe Forschungs- und Entwicklungsbedarf im Bereich der Weiterentwicklung medikamentöser Trägersysteme:
- erstens auch für andere medikamentös wirksame Substanzen,
- zweitens erforderlichenfalls in Abhängigkeit von der medikamentösen Substanz in der Prolongierung der Abgabezeit und
- drittens in der Erreichung bisher für die Trägersysteme unerreichbarer Bereiche [Di Turi G et al.].
Was wünschen Sie sich für den Praxisalltag?
Rossberg: In Bezug auf die Anwendung lokaler Antibiotika wären weitere Untersuchungen sinnvoll, um Einsatzbereiche und Indikationen genauer zu definieren und für Kollegen in freier Praxis einen Leitfaden zu Indikation und Einsatzumfang zu schaffen.
Wie Prof. Dr. Ratka-Krüger plädiere ich auch für Forschungsförderung im Bereich der Periimplantitistherapie.
Sinnvoll wäre ferner eine bessere Vernetzung der praktizierenden Zahnärzte, um spezialisierte Kollegen mit in eine interdisziplinäre Behandlung einzelner Patienten einzubeziehen. Das kann die Behandlungsqualität in der Parodontologie erhöhen. Denn für uns Niedergelassene es ist schwer, alle Bereiche auf dem gleichen Niveau abzudecken.
Zusammenfassung
- Lokale Antibiotika sind ein die nicht-chirurgische mechanische Parodontitistherapie ergänzendes Therapiemittel.
- Sie werden bevorzugt bei Recallpatienten mit einzelnen persistierenden oder rezidivierenden Taschen mit Sondierungstiefen ≥ 5 mm und „Bluten auf Sondieren“ eingesetzt.
- Das Risiko der Resistenzbildung ist bei der lokalen Antibiotikatherapie vergleichsweise gering.
- Bei richtiger Indikationsstellung gibt es praktisch keine Nebenwirkungen, die Wirkung ist auf die behandelte Zahnfleischtasche beschränkt.
- Entscheidend für die Präparatauswahl sind die Praktikabilität der Wirkstoffapplikation und die Applikationsform: Es muss eine therapeutische Wirkstoffkonzentration über einen ausreichenden Zeitraum gewährleistet werden.
- Studien belegen: Lokale Antibiotika in Kombination mit mechanischer Therapie zeigen eine signifikante Wirksamkeit bei tiefen Taschen und bei Resttaschen.
- Während lokale Antibiotika bei der Parodontitisbehandlung bereits sehr gut untersucht sind, fehlen bei der Periimplantitistherapie entsprechende Studien. Hier besteht Forschungsbedarf.
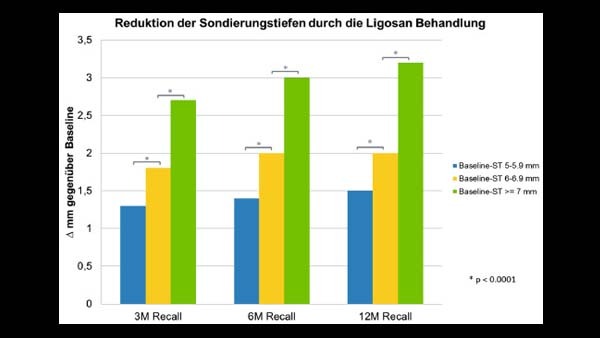
Anwendungsbeobachtung Ligosan Slow Release
Im Rahmen der deutschlandweiten AWB wurde Ligosan Slow Release von über 150 Zahnärzten in der adjuvanten Parodontaltherapie bei Patienten mit chronischer oder aggressiver Parodontitis eingesetzt. Insgesamt wurden 1.189 Zähne mit einer Ausgangstaschentiefe von ≥ 5 mm bei 451 Patienten in die finale Analyse eingeschlossen. Recalluntersuchungen wurden nach drei, sechs und zwölf Monaten durchgeführt.
Schlussfolgerung
Die Ergebnisse der Anwendungsbeobachtung bestätigen die Ergebnisse der klinischen Wirksamkeitsstudien zu Ligosan Slow Release: Auch unter Praxisbedingungen ist durch den Einsatz von Ligosan Slow Release eine signifikante Reduktion der Sondierungstiefen und eine Verbesserung des Attachment-Levels erzielbar.
Quelle: Heraeus Kulzer, Finale Auswertung Anwendungsbeobachtung
Klinische Wirksamkeit
Die klinische Wirksamkeit wird z. B. in der Studie von Eickholz P et al. gezeigt. Die ergänzende subgingivale Applikation eines bioresorbierbaren Doxyzyklingels bewirkte bessere Attachment-Level-Gewinne und Taschentiefenreduktionen als die rein nichtchirurgische Therapie bzw. ein Placebo. Der Einfluss der ergänzenden subgingivalen Applikation eines bioresorbierbaren 14%igen Doxyzyklingels (Ligosan Slow Release) auf parodontale Pathogene, sowie auf eine mögliche Resistenzbildung wurde in der Studie von Ratka-Krüger et al. untersucht: Die adjunktive subgingivale Applikation eines 14%igen Doxyzyklingels (Ligosan Slow Release) resultierte in deutlicher Reduktion der parodontal pathogenen Keime nach drei Monaten und stabilen Ergebnissen bis zu sechs Monate nach Therapie. Eine Resistenzbildung gegenüber Doxyzyklin wurde nach Anwendung von Ligosan Slow Release nicht beobachtet. Hinsichtlich der Pharmakokinetik wurde nachgewiesen, dass sich der antibiotische Effekt eines lokal applizierten Doxyzyklingels überwiegend auf den Ort der Anwendung beschränkt [Kim T et al.]. Nach subgingivaler Applikation von Ligosan Slow Release konnten im Sulkusfluid über einen Zeitraum von zwölf Tagen durchschnittliche Doxyzyklinkonzentrationen von 16 g/ml gemessen werden. Die Doxyzyklinserumwerte lagen – außer bei einem Patienten bis zu drei Tage nach Applikation – unterhalb der Nachweisgrenze [Kim T et al.]. Quelle: Heraeus Kulzer
Prof. Dr. Petra Ratka-Krüger leitet die Sektion Parodontologie an der Zahnklinik Freiburg sowie den Studiengang MasterOnline Parodontologie und Periimplantäre Therapie. Zu ihren Schwerpunkten zählen u. a.: Einfluss von Allgemeinerkrankungen auf das Parodont, regenerative und plastische Parodontalchirurgie.
Kontakt: petra.ratka-krueger@uniklinik-freiburg.de
Dr. Andrea Leyer studierte Zahnmedizin in Regensburg und ist seit 2012 Scientific Affairs Manager Indirect Restorations, Pain Control and Disease Management bei Heraeus Kulzer. Zuvor war sie als Assistenzzahnärztin an der Zahnklinik/Zahnerhaltung und Parodontologie des Universitätsklinikums Erlangen tätig.
Kontakt: andrea.leyer@kulzer-dental.com
Dr. Sylke Dombrowa
studierte Biologie/Mikrobiologie in Göttingen und ist seit 1998 Produktmanagerin für dentale Diagnostik bei der Fa. Hain Lifescience GmbH. Sie ist als Referentin und Autorin auf dem Gebiet der oralen Mikrobiologie und der molekularbiologischen Dentaldiagnostik national und international aktiv.
Kontakt: sylke.dombrowa@hain-lifescience.de
Dr. Georg Gaßmann
studierte nach abgeschlossener Zahntechnikerausbildung Zahnmedizin an der Universität Köln und war zunächst als wissenschaftlicher Mitarbeiter, dann als Oberarzt in der Abteilung für Parodontologie an der Universität Witten/Herdecke tätig. Seit 2004 ist er national und international als Referent aktiv.
Kontakt: dr_georg.gassmann@yahoo.com
Dr. Thomas Bürklin
studierte Zahnmedizin in Frankfurt a. M. und ist seit 2003 niedergelassen in einer Gemeinschaftspraxis mit Dr. Erik Neukranz in Bad Soden a. T. Seit 2006 ist er DGParo-Spezialist für Parodontologie und seit 2007 Teletutor im Studiengang MasterOnline Parodontologie und periimplantäre Therapie der Uni Freiburg.
Kontakt: mail@dr-buerklin.de
Dr. Matthias Roßberg
studierte Zahnheilkunde in Frankfurt/M.,und ist seit 2009 niedergelassen in eigener Praxis in Darmstadt. Wissenschaftliche Schwerpunkte: Plastische Parodontalchirurgie, mikrobiologische Diagnostik, regenerative Parodontitistherapie, Behandlungsschwerpunkte: Parodontologie, Ästhetische Zahnheilkunde
Kontakt: matthias.rossberg@yahoo.de
> Lesen Sie hier das Thema: Chlorhexidin versus lokale Antibiose
Literatur Dr. Georg Gaßmann
1) Agarwal E, Bajaj P, Naik SB, Pradeep AR. LocallyDelivered 0.5% Azithromycin, as an AdjuncttoNon Surgical Treatment in Chronic Periodontitis With Type 2 Diabetes: A RandomizedControlled Clinical Trial. J Periodontol. 2012 Jun 1.
2) Bajaj P, Pradeep AR, Agarwal E, Kumari M, Naik SB. Locallydelivered 0.5% clarithromycin, as an adjuncttononsurgicaltreatment in chronicperiodontitiswith well-controlled type 2 diabetes: a randomizedcontrolledclinicaltrial. J InvestigClinDent. 2012 Nov;3(4):276–83.
3) Bland PS, Goodson JM, Gunsolley JC, Grossi SG, Otomo-Corgel J, Doherty F, Comiskey JL. Associationofantimicrobialandclinicalefficacy: periodontitistherapywithminocyclinemicrospheres. J IntAcadPeriodontol. 2010 Jan;12(1):11–9.
4) Di Turi G, Riggio C, Vittorio O, Marconcini S, Briguglio F, Funel N, Campani D, Barone A, Raffa V, Covani U. Sub-micrometricliposomesasdrugdeliverysystems in thetreatmentofperiodontitis. Int J ImmunopatholPharmacol. 2012 Jul-Sep;25(3):657–70.
5) Eickholz P, Kim TS, Bürklin T, Schacher B, Renggli HH, Schaecken MT, Holle R, Kübler A, Ratka-Krüger P. Non-surgicalperiodontaltherapywithadjunctivetopicaldoxycycline: a double-blind randomizedcontrolledmulticenterstudy. J ClinPeriodontol. 2002 Feb;29(2):108–17.
6) Eickholz P, Kim TS, Schacher B, Reitmeir P, Bürklin T, Ratka-Krüger P. Subgingivaltopicaldoxycyclineversusmechanicaldebridementforsupportiveperiodontaltherapy: a single blindrandomizedcontrolledtwo-center study. Am J Dent. 2005 Dec;18(6):341–6.
7) Ficarra G, Beninati F, Rubino I, Vannucchi A, Longo G, Tonelli P, Pini Prato G. Osteonecrosisofthejaws in periodontalpatientswith a historyofbisphosphonatestreatment. J ClinPeriodontol. 2005 Nov;32(11):1123–8.
8) Grenier D, Plamondon P, Sorsa T, Lee HM, McNamara T, Ramamurthy NS, Golub LM, Teronen O, Mayrand D. Inhibition ofproteolytic, serpinolytic, andprogelatinase-b activationactivitiesofperiodontopathogensbydoxycyclineandthe non-antimicrobialchemicallymodifiedtetracycline derivatives. J Periodontol. 2002 Jan;73(1):79–85.
9) Grossi SG, Skrepcinski FB, DeCaro T, Robertson DC, Ho AW, DunfordRG, Genco RJ Treatment ofperiodontaldisease in diabeticsreducesglycatedhemoglobin. J Periodontol. 1997 Aug;68(8):713–9.
10) Grossi SG. Treatment ofperiodontaldiseaseandcontrolofdiabetes: an assessmentoftheevidenceandneedforfutureresearch. Ann Periodontol. 2001 Dec;6(1):138–45.
11) Hauser-Gerspach I, Vadaszan J, Deronjic I, Gass C, Meyer J, Dard M, Waltimo T, Stübinger S, Mauth C. Influenceofgaseousozone in peri-implantitis: bactericidalefficacyandcellularresponse. An in vitro studyusingtitaniumandzirconia. Clin Oral Investig. 2012 Aug;16(4):1049–59.
12) Kim TS, Bürklin T, Schacher B, Ratka-Krüger P, Schaecken MT, Renggli HH, Fiehn W, Eickholz P. Pharmacokineticprofileof a locallyadministereddoxycyclinegel in crevicular fluid, blood, andsaliva. J Periodontol. 2002 Nov;73(11):1285–91.
13) Mombelli A, Samaranayake LP. Topicalandsystemicantibiotics in themanagementofperiodontaldiseases. IntDent J. 2004 Feb;54(1):3–14.
14) Montevecchi M, Dorigo A, Cricca M, Checchi L. Comparisonoftheantibacterialactivityof an ozonatedoilwithchlorhexidinedigluconateandpovidone-iodine. A diskdiffusiontest. New Microbiol. 2013 Jul;36(3):289–302.
15) Park JB. Effectsofdoxycycline, minocycline, andtetracycline on cellproliferation, differentiation, andproteinexpression in osteoprecursorcells. J CraniofacSurg. 2011 Sep;22(5):1839–42.
16) Park JB. Low dose ofdoxycylinepromotesearlydifferentiationofpreosteoblastsbypartiallyregulatingtheexpressionofestrogenreceptors. J Surg Res. 2012 Dec;178(2):737–42.
17) Pradeep AR, Kathariya R. Clarithromycin, as an adjuncttonon surgicalperiodontaltherapyforchronicperiodontitis: a double blinded, placebocontrolled, randomizedclinicaltrial. Arch Oral Biol. 2011 Oct;56(10):1112–9.
18) Ratka-Krüger P, Schacher B, Bürklin T, Böddinghaus B, Holle R, Renggli HH, Eickholz P, Kim TS. Non-surgicalperiodontaltherapywithadjunctivetopicaldoxycycline: a double-masked, randomized, controlledmulticenterstudy. II. Microbiologicalresults. J Periodontol. 2005 Jan;76(1):66–74.
19) Renvert S, Lessem J, Dahlén G, Renvert H, Lindahl C. Mechanicalandrepeatedantimicrobialtherapyusing a localdrugdeliverysystem in thetreatmentofperi-implantitis: a randomizedclinicaltrial. J Periodontol. 2008 May;79(5):836–44.
20) Saini R. Ozonetherapy in dentistry: A strategicreview. J NatSciBiol Med.2011 Jul;2(2):151–3.
21) Sakellari D, Ioannidis I, Antoniadou M, Slini T, Konstantinidis A. Clinical andmicrobiologicaleffectsofadjunctive, locallydeliveredchlorhexidine on patientswithchronicperiodontitis. J IntAcadPeriodontol. 2010 Jan;12(1):20–6.
22) Sgolastra F, Petrucci A, Gatto R, Monaco A. Effectivenessofsystemicamoxicillin/metronidazoleas an adjunctivetherapytofull-mouthscalingandrootplaning in thetreatmentof aggressive periodontitis: a systematicreviewandmeta-analysis. J Periodontol. 2012 Jun;83(6):731–43.
23) van Winkelhoff AJ. Antibiotics in thetreatmentofperi-implantitis. Eur J Oral Implantol. 2012;5 Suppl:S43–50.
Literatur Dr. Andrea Leyer
Mombelli A W et al.: Actinobacillusactinomycetemcomitans in adult periodontitis. II. Characterization of isolated strains and effect of mechanical periodontal treatment J Periodontol 65: 827–834 (1994)
Mombelli A W et al.: Can P. gingivalis (PG) and A. actinomycetemcomitans (AA) be eradicated with local amentum and radicular dentin of periodontally diseases teeth in humans. J Periodontol 59: 222–230 (1988)
Adriaens P A et al.: Bacterial invasion in root cementum and radicular dentin of periodontally diseases teeth in humans. J Periodontol 59: 222–230 (1988)
(Christersson L A et al.: Tissue localization of Actinobacillusactinomycetemcomitans in human periodontitis. J Periodontol 58: 540–545 (1987)
()Rajabalian S, Mohammadi M, Mozaffari B. Cytotoxicity evaluation of Persica mouthwash on cultured human and mouse cell lines in the presence and absence of fetal calf serum. Indian J Dent Res 2009;20:169–73
( Zyba V. rkung von antiseptischen Mundspüllösungen auf die menschlichen Zellen der Mundschleimhaut.Eine in-vitro-Studie. Dissertation, Universität Göttingen, 2010
( Ratka-Krüger P et al., J Periodontal. 2005 Jan;(1): 66 – 74: Non-surgical periodontal therapy with adjunctive topical doxycycline:a double-masked, randomized,controlled multicenter study. II. Microbiological results.
( Preshaw PM et al., J Clin Periodontal. 2004 Sept;31 (9): 697 – 707: Subantimicrobial dose doxycycline as adjunctive treatment for periodontitits. A review.
() Metzger Z et al., IntEndod J. 2008 Apr; 41 (4): 303 – 9: Low-dose doxycycline inhibits bone resorption associated with apical periodontitis.
Literatur Dr. Matthias Roßberg
Eickholz P, Dannewitz B, Kim T-S. Antibiotika in der Parodontologie. Die Quintessenz 2004; 55:375–388.
Kim T; Le, S-H, Eickholz P, Klimpel H, Fiehn W, Kim C-K. Systemischer Nachweis von Doxyzyklin nach lokaler Applikation. Dtsch Zahnärztl 2005; 60:348–353.
Greenstein G. Local drug delivery in the treatment of periodontal diseases: assessing the clinical significance of the results. J Periodontol 2006; 77:565–578.
Hanes PJ, Purvis JP. Local anti-infective therapy: Pharmacological agents. A systematic review. Ann Periodontal 2003; 8:79–98.
Slots J, Ting M. Systemic antibiotics in the treatment of periodontal disease. Periodontal 2000 2002; 28:106–176.
Renvert S, Lessem J, Dahlen G, Lindahl C, Svensson M. Tocical minocycline microspheres versus topical chlohexidine gel as an adjunct to mechanical debridement of incipient peri-implant infections: randomized clinical trial. J Clin Periodontol 2006; 33:362–369.
Stoltze K. Concentration of metronidazole in periodontal pockets after application of metronidazole 25% gel. J Clin Periodontol 1992; 19:698–701.
Literatur Dr. Sylke Dombrowa
Ratka-Krüger P., et al., 2005: Non-surgical periodontal therapy with adjunctive topical doxycycline: a double-masked, randomized, controlled multi-center study.
Wennström et, 2001. Utilisation of locally delivered doxycycline in non-surgical treatment of chronic periodontitis. A comparative multi-centre trial of 2 treatment approaches.
Eickholz P, et al., 2002 : Non-surgical periodontal therapy with adjunctive topical doxycycline: a double blind randomized controlled multicenter study
Matesanz-Pérez P. et al., 2013: A systematic review on the effects of local antimicrobials as adjuncts to subgingival debridement, compared with subgingival debridement alone, in the treatment of chronic periodontitis.